Содержание
Одна из важнейших функций, которую выполняют белки в организме, — защитная. Иммунной защите отводится особая роль.
Ядро иммунной системы составляют три типа белков: иммуноглобулины (антитела), интерфероны и белки главного комплекса гистосовместимости. Они являются главными участниками формирования иммунного ответа — способности организма адекватно реагировать на чужеродную информацию и противостоять воздействию патогенов. Ежедневное удовлетворение потребности в белке принципиально важно для иммунной защиты.
Влияет ли белковый дефицит на течение болезни и процесс выздоровления? Что такое аминокислотный скор и какова его роль в удовлетворении потребности в белке? Мы узнали мнения экспертов.
Стабильность — залог успеха
Недостаточное потребление белка и, как следствие, формирование его дефицита в организме нарушает работу всех органов и систем, включая ослабление защитной функции. Основные факторы защиты организма — иммуноглобулины и система комплемента, равно как и фундамент клеток-защитников (лимфоцитов) — все это белковые структуры. Соответственно, без удовлетворения потребности в белке иммунная система адекватно работать не сможет. Все иммунодефициты различной степени выраженности так или иначе сопровождаются нарушениями белкового обмена. Даже легкие формы белковой недостаточности, которые не имеют клинических проявлений и протекают бессимптомно, оказывают негативное влияние на формирование иммунного ответа организма на атаку патогенов, воздействие повреждающих и стрессовых факторов.
Соответственно, без удовлетворения потребности в белке иммунная система адекватно работать не сможет. Все иммунодефициты различной степени выраженности так или иначе сопровождаются нарушениями белкового обмена. Даже легкие формы белковой недостаточности, которые не имеют клинических проявлений и протекают бессимптомно, оказывают негативное влияние на формирование иммунного ответа организма на атаку патогенов, воздействие повреждающих и стрессовых факторов.
Синтез и распад белков в организме — процесс непрерывный. Важность сохранения его стабильности, в том числе для обеспечения иммунной защиты, обусловлена тем, что белок не депонируется в организме, то есть не накапливается для дальнейшего рационального использования. Это особенно актуально для детского возраста, когда все процессы в организме проходят наиболее интенсивно. А вместе с тем на фоне высоких потребностей в макро- и микронутриентах и энергии у детей имеются ограниченные резервы и тенденция к быстрому их истощению. Не допустить дефицит белка важно как для гармоничного роста и развития, так и для формирования крепкого иммунитета.
Еда, которая лечит
Наверное, ни одной семьи, которая бы в отношении своего болеющего родственника сказала: давайте будем кормить его меньше и реже. Один из известнейших ученых в области нутрициологии Бертольд Колецко показал, что даже незначительное повышение температуры тела до субфебрильных цифр повышает потребности в белке на 150–180 % от базовой. При обострении хронической патологии — на 200–250 %, при травме — на 300 %. Вместе с тем есть данные, что почти каждый второй пациент с респираторными заболеваниями страдает от нутритивной недостаточности.
В этом контексте не обеспечивать больному питание, богатое содержанием белка, значит попросту не долечивать его, убеждена Елена Полевиченко. Адекватный состоянию болеющего человека рацион в этом случае расценивается не как удовлетворение его базовых потребностей, а как один из факторов комплексной терапии, повышения иммунных и адаптационных сил организма. Научно доказано, что ежедневное употребление высокобелковой пищи во время болезни и лечения снижает вероятность осложнений, уменьшает побочные эффекты применяемых лекарственных средств и ускоряет процесс выздоровления.
Белок белку рознь
Чтобы обеспечить стабильный биосинтез белка, а значит и адекватную работу иммунной системы, необходимо постоянно пополнять фонд аминокислот в организме. Именно они выступают главным структурным компонентом белков и влияют на их функциональное предназначение. Источником аминокислот служат пищевые продукты.
Белки животного и растительного происхождения усваиваются организмом по-разному. Так, усвояемость молока, молочных продуктов, яиц составляет 96 %. Мяса, рыбы — 93–95 %. А вот белки, содержащиеся в хлебе, организм усваивает лишь на 62–86 %, в картофеле — на 70 %, что определяется сбалансированностью аминокислотного состава. Качество белка определяется таким понятием, как аминокислотный скор, то есть сбалансированным наличием всех незаменимых аминокислот в продукте. Эталоном аминокислотного скора принято считать эталонный белок, разработанный экспертами ФАО/ВОЗ, а также белок грудного молока и куриного яйца. Близкими к нему — животные белки из мяса, птицы, молока. Эти же продукты выступают источником витаминов D, А, витаминов группы В, кальция, фосфора и т. д.
Эти же продукты выступают источником витаминов D, А, витаминов группы В, кальция, фосфора и т. д.
Сочетание в рационе продуктов растительного и животного происхождения для укрепления иммунитета может расцениваться как биологически более полноценное из-за взаимного обогащения одних белков аминокислотами других. При этом суточная потребность в белке должна восполнять как общий расход белка, так и потребность в незаменимых аминокислотах. Разбалансировка аминокислотного состава чревата нарушением азотистого баланса (количество потребляемых белков должно быть адекватно продуктам их распада, которые выделяются из организма), что в свою очередь ведет к ослаблению иммунной защиты.
Более того, положительный азотистый баланс (превышение потребления белковых продуктов над потерями) необходимо обеспечить в периоды интенсивного роста и развития (в детском и подростковом возрасте), повышенных нагрузок на органы и системы (беременность, лактация), во время болезни и восстановления.
Таким образом наряду с привычной пищей, богатой белком (мясо, птица, молоко), более чем оправданно включение в рацион кисломолочных напитков, которые содержат до 30 г белка на 250 мл продукта, обогащены лактобактериями, витаминами D и В6. В основе напитков — сывороточные белки, которые имеют оптимальный аминокислотный состав и усваиваются практически полностью. При отсутствии аппетита, затрудненном глотании они, по сути, могут выступать основным источником белка, необходимого организму для повышения иммунных сил.
В основе напитков — сывороточные белки, которые имеют оптимальный аминокислотный состав и усваиваются практически полностью. При отсутствии аппетита, затрудненном глотании они, по сути, могут выступать основным источником белка, необходимого организму для повышения иммунных сил.
Следуя принципам превентивной медицины, ежедневное (а не только в период болезни) включение в рацион высокобелковых продуктов может служить средством обеспечения эффективной работы иммунной системы и повышения резервных и адаптивных возможностей организма перед воздействием патогенов и внешних негативных факторов
Заместитель главного врача по медицинской части
Харитонюк В.Н.
об исследованиях структуры белка, их роли в понимании патогенеза болезней и важности разнообразного CV
— Дмитрий, вы, как я поняла, занимаетесь изучением белков. И начать я хотела бы совсем со школьных азов. Что такое белки?
— Белки, говоря формально, — это гетерополимеры. А полимеры — это длинные молекулы, собранные из каких-либо звеньев. Бывают гомополимеры, составленные из одинаковых звеньев (со школьной скамьи все помнят полистирол или полиэтилен), а бывают гетерополимеры — из разных. Белки состоят из 20 типов аминокислот, еще две используются в зависимости от контекста. На самом деле, аминокислот намного больше, но природа в белках использует лишь эти 20. Хотя если считать так называемые посттрансляционные модификации (ковалентные химические модификации белка после его синтеза на рибосоме — прим. авт.), их будет значительно больше.
А полимеры — это длинные молекулы, собранные из каких-либо звеньев. Бывают гомополимеры, составленные из одинаковых звеньев (со школьной скамьи все помнят полистирол или полиэтилен), а бывают гетерополимеры — из разных. Белки состоят из 20 типов аминокислот, еще две используются в зависимости от контекста. На самом деле, аминокислот намного больше, но природа в белках использует лишь эти 20. Хотя если считать так называемые посттрансляционные модификации (ковалентные химические модификации белка после его синтеза на рибосоме — прим. авт.), их будет значительно больше.
— Почему именно такое число?
— Таков генетический код. Его расшифровали в 1960-х годах и выяснили, что аминокислот 20. И столь потрясающая универсальность наблюдается у всех живых организмов — все они имеют один и тот же генетический код и набор аминокислот. Некоторые вариации генетического кода, конечно, существуют, но их всего около 15, и они незначительны. А полипептидов — астрономическое число. Но не все из них становятся белками, потому что белки обладают особым свойством — выполнять разные функции в организме.
Но не все из них становятся белками, потому что белки обладают особым свойством — выполнять разные функции в организме.
— Чем же белок отличается от случайной полипептидной цепи?
— В ходе эволюции сложился такой порядок аминокислот, при котором конкретная белковая молекула определяет трехмерную форму белка. Эта форма стабильная и жесткая, поэтому она способна выполнять какие-то функции. Поясню: возьмем, например, ножницы. У них есть функция — резать. Почему они могут это делать? Во-первых, потому что они твердые, а во-вторых, потому что у них есть острые лезвия. Если бы у нас был кусок киселя даже в форме ножниц, ничего разрезать им мы бы не смогли. То же самое с белками: есть, к примеру, белки, которые разрезают другие молекулы (ДНК, РНК, другие белки). И для этого им нужна определенная жесткая форма. Этим белки и отличаются от случайных полипептидов.
— Какие еще функции выполняют белки?
— Белки выполняют 99,9% функций в нашем организме, практически все, которые существуют. Одно из исключений — рибосомы, на которых производятся белковые цепи, согласно инструкции, записанной в матричной РНК. То же самое относится к рибозимам — молекулам РНК, которые также способны сворачиваться в строго определенную трехмерную форму и выполнять свои задачи.
Одно из исключений — рибосомы, на которых производятся белковые цепи, согласно инструкции, записанной в матричной РНК. То же самое относится к рибозимам — молекулам РНК, которые также способны сворачиваться в строго определенную трехмерную форму и выполнять свои задачи.
В целом, функции белков можно разложить по нескольким категориям. Одна из них — гормональная. За нее отвечает, например, такой известный белок, как инсулин. Инсулин — это первый белок, у которого была определена последовательность аминокислот. Это сделал Фредерик Сенгер, за что и получил первую Нобелевскую премию.
Еще одна функция — транспортная. Ею занимается, скажем, гемоглобин, который, находясь в составе эритроцитов, связывает кислород. Последний, в свою очередь, несется к мышцам, а там передает кислород другому белку — миоглобину. Гемоглобин и миоглобин — это первые два белка, для которых были определены трехмерные структуры, расшифрованные методом рентгеноструктурного анализа, за что Перуцу и Кендрью была вручена Нобелевская премия.
Есть еще каталитическая функция, которая осуществляется при помощи специальных белков — ферментов. Они катализируют какую-либо реакцию. Так, фермент алкогольдегидрогеназа, как можно догадаться из названия, расщепляет алкоголь. Соединительной функцией занимается, например, коллаген — белок, составляющий основу соединительной ткани организма (сухожилий, костей, хрящей). Существуют у белков и другие задачи. В целом можно сказать так: в нашем организме более 20 тысяч генов. И почти все из них — гены, кодирующие белки. Это о многом говорит.
— Что интересного сегодня происходит в науке о белках?
— Очень своевременный вопрос: если бы вы задали его до лета 2018 года, то мой ответ был бы совершенно другим. Что у нас случилось? Прорыв! Немного предыстории. В 1961 году было экспериментально показано, что трехмерная форма белка, о которой мы говорили, определяется исключительно аминокислотной последовательностью (до этого думали, что в этом играют роль рибосомы). А в 1969 году это подтвердилось окончательно, когда без участия рибосомы химически синтезировали полностью функциональный белок. Поэтому ученые рассудили: если мы знаем аминокислотную последовательность — мы можем предсказать и трехмерную структуру белка. Но на деле все оказалось не так просто.
Поэтому ученые рассудили: если мы знаем аминокислотную последовательность — мы можем предсказать и трехмерную структуру белка. Но на деле все оказалось не так просто.
В итоге прошло полвека непрерывных попыток — частичных успехов и разочарований. И вот, в 2018 году компания DeepMind, которая принадлежит Google, представила уникальную программу AlphaFold по предсказанию трехмерной структуры белка. Интересно, что «разминались» они на создании программ по игре в шахматы и го, у которых похожий принцип — обучаться на примере удачных и неудачных ходов, которые ведут то к победе, то к поражению. Шахматная программа стала умной до такой степени, что за шесть часов тренировки при определенном количестве процессоров оказалась способна обыграть любого человека в мире.
И в 2020 году путем тренировок AlphaFold добилась другого успеха — в предсказаниях структуры белков. Точность таковых — от 88% до 90%, почти как в экспериментах. Это очень хороший результат. И теперь любой желающий может установить эту программу и получить возможность предсказывать трехмерные структуры практически с экспериментальной точностью. А может зайти в базу данных моделей AlphaFold, и найти структуру любого известного белка .
А может зайти в базу данных моделей AlphaFold, и найти структуру любого известного белка .
— И что нам это дает?
— Очень многое. Ведь зная трехмерную структуру белка, мы можем узнать и о его функции. Сегодня на планете свирепствует коронавирус. Известно, что он зацепляется за клетку хозяина при помощи так называемого шипикового (спайкового) белка, о котором было много шума и публикаций. Теперь мы знаем его структуру, что дает нам возможность борьбы с этим вирусом. И не только с ним, но и с другими заболеваниями. Этот успех может облегчить поиск нужных лекарств, разработку новых вакцин и антибиотиков.
Кроме того, это будет способствовать прогрессу в создании белков с заданными свойствами. Сфера применения таковых не ограничивается биологией и медициной. Взять ту же промышленность, где уже сегодня белки используют в качестве биодобавок в стиральных порошках — там они играют роль тех самых «умных молекул», о которых нам рассказывает реклама. Есть сладкие на вкус белки, которые могут служить безопасными заменителями сахара.
— Над чем конкретно работаете вы?
— Мне как раз очень интересна тема структуры белка и ее изменений. Дело в том, что при внесении «мутаций» в белки мы можем добиться улучшения необходимых нам свойств. Например, можно сделать белки более устойчивыми к высокой температуре или уровню pH. Над этим сейчас и работает наша лаборатория. А вообще хочется добиться экспертизы уровня группы Дэвида Бейкера (знаменитого американского биохимика и компьютерного биолога, который впервые разработал методы прогнозирования и проектирования трехмерных структур белков — прим. авт.), директора Института белкового дизайна, который и создали специально в результате его успехов. Он, конечно, берется за очень серьезные задачи — например, с нуля создает белок, которые светится каким-нибудь цветом. А в конце 2000-х его команда сгенерировала белок, катализирующий реакцию, которая не существует в природе. Так что есть мечта — добиться похожих результатов.
Дмитрий Иванков на семинаре.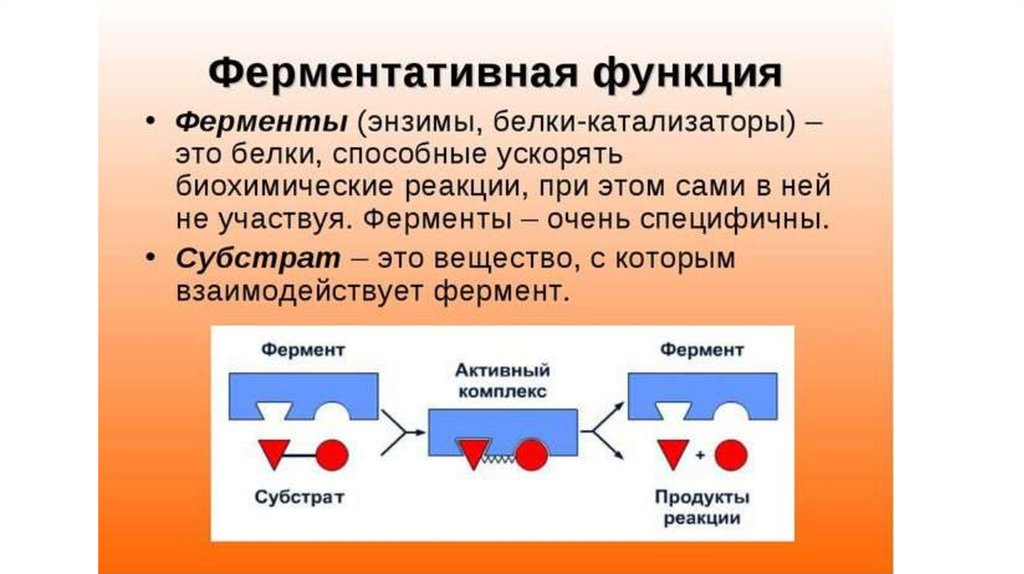 Источник: Тимур Сабиров
Источник: Тимур Сабиров
— Кстати, как вы вообще пришли в биологию?
— Вы знаете, в школе мне была интересна вовсе не биология, а физика и математика. И после одной из олимпиад учительница физики перетянула меня в физмат класс. А после этого, на выпускном, сагитировала поступить в МФТИ и убедила в этом моих родителей, за что я ей и моим родителям очень благодарен. Я поступил также на физфак в МГУ, но выбрал МФТИ и пошел на тот факультет, куда всегда хотел — радиотехники и кибернетики. На кафедру системного программирования — как раз к тому коллективу авторов, который создал отечественный суперкомпьютер.
И тут один мой друг случайно рассказал мне об Институте белка РАН. Он сообщил, что Алексей Витальевич Финкельштейн — в дальнейшем мой первый научный руководитель, член-корреспондент Российской академии наук и совершенно замечательный человек и ученый, возглавляющий в Пущино Лабораторию физики белка, — ищет студента для выполнения задачи. Я тогда пообещал своему другу приехать, а у самого мысли: «Какая ерунда, где я — и где белки?». Я тогда даже не знал, что такое белки! Но приехал.
Я тогда пообещал своему другу приехать, а у самого мысли: «Какая ерунда, где я — и где белки?». Я тогда даже не знал, что такое белки! Но приехал.
Оказалось, там очень интересный сегмент работы, и Алексей Витальевич меня сразу принял. А потом выяснилось, что мне даже не надо переводиться на другой факультет. Так я и учился на кафедре системного программирования, сочиняя для диплома программу про сворачивание белков. На защите рассказывал, что такое белки, как они сворачиваются. Одним очень понравилось, другие, наоборот, были недовольны тем, что их отвлекают от работы по проектированию микропроцессоров и системного программирования всякой ерундой. После этого я пошел стажером-исследователем, а затем аспирантом в Институт белка и проработал там до конца 2009 года, после чего продолжил работать за границей.
Знаете, в академической среде есть принцип — нужно менять место работы и браться за новые проекты. Потому что чем больше таких мест работы в CV, тем богаче у тебя опыт. Да мне вообще казалось, что в моей области никаких глобальных вопросов уже нет, поэтому я поехал за рубеж — узнать, что происходит в соседних областях науки. Сначала четыре года поработал постдоком в Германии в Техническом университете Мюнхена у профессора Дмитрия Фришмана, потом четыре года в Барселоне у другого профессора — Федора Кондрашова. Потом вся лаборатория Федора переехала в Австрию, и я вместе с ней.
Да мне вообще казалось, что в моей области никаких глобальных вопросов уже нет, поэтому я поехал за рубеж — узнать, что происходит в соседних областях науки. Сначала четыре года поработал постдоком в Германии в Техническом университете Мюнхена у профессора Дмитрия Фришмана, потом четыре года в Барселоне у другого профессора — Федора Кондрашова. Потом вся лаборатория Федора переехала в Австрию, и я вместе с ней.
— Как вам помог такой разносторонний опыт общения с коллегами?
— Расширением работы моей лаборатории. Потому что одно ее направление — это изучение структуры белков, а второе — эволюция, исследование эпистаза (типа взаимодействия генов между собой — прим. авт.). Последний вектор возник благодаря тому, что я работал в Лаборатории эволюционной геномики у Федора Кондрашова. Я уже не говорю о том, что международный опыт значительно расширяет круг интересов, старые знания сочетаются с новыми. Поэтому чем старше исследователь, тем шире его кругозор, тем более зрел и целостен его взгляд на науку.
Теги
Интервью
2.9: Белки — Биология LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 24741
- Bio-OER
- City Tech CUNY
Белки представляют собой полимеры аминокислот
Белки обеспечивают большую часть структурных и функциональных возможностей клеток. Белки состоят из мономеров, называемых аминокислотами. Аминокислоты представляют собой углеводороды, которые имеют аминогруппу (-NH 2 ) и кислотную карбоксильную группу (-COOH). Группа R представляет собой углеводородную цепь с модификацией, которая изменяет свойства аминокислоты.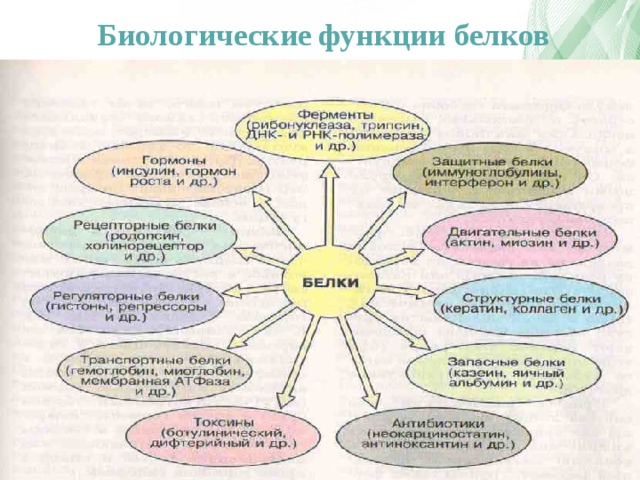 20 универсальных аминокислот используются для построения белков. Изменение функциональных групп вдоль аминокислотной цепи приводит к функциональному разнообразию белков.
20 универсальных аминокислот используются для построения белков. Изменение функциональных групп вдоль аминокислотной цепи приводит к функциональному разнообразию белков.
20 аминокислот и их свойства. 21-я аминокислота в этой таблице представляет собой не повсеместно встречающийся селеноцистеин.
Мономеры связываются друг с другом посредством реакции синтеза дегидратации между соседними амино- и карбоксильными группами с образованием пептидной связи .
Три аминокислоты связаны в трипептид.
Как аминокислоты взаимодействуют друг с другом и с окружающей средой
Используйте следующее моделирование, чтобы проверить, как полипептидная цепь со сгибом зависит от типа раствора, в котором она находится, и состава аминокислот.
- Моделирование фолдинга белков (CC BY 4.0 Concord Consortium)
Уровни структуры
- Первичная структура (1°) : Последовательность аминокислот, прочитанная от амино или N-конца молекулы до карбоксила или С-конца
- Tyr-Cys-Arg-Phe-Leu-Val-….

- Tyr-Cys-Arg-Phe-Leu-Val-….
- Вторичная структура (2°) : локальные трехмерные структуры, которые образуются в результате взаимодействия аминокислот, например водородных связей.
- Альфа-спираль – завитки, происходящие из Н-связей между группами NH и C=O вдоль остова белка
Side view of α-helix illustrating H-bonds in magenta between carboxyl oxygen (red) and amine nitrogen (blue)
Top-down вид α-спирали
Ленточная диаграмма α-спиралей, пересекающих мембрану, вид сбоку.
- Бета-листы – латерально соединенные нити или листы аминокислот, происходящие из Н-связей между группами NH и C=O вдоль скелета белка
Ленточная диаграмма β-листов
- Третичная структура (3°) : общая трехмерная структура пептидной цепи
- Четвертичная структура (4°) : мультимерная структура белка из сборки нескольких пептидных субъединиц
youtube.com/embed/wvTv8TqWC48?feature=oembed»>
Разнообразие белков
Узнайте больше о сложности белковых структур в Банке данных о белках.
Теория обнаружения белков:
Белки можно обнаружить с помощью биуретового теста . В частности, пептидные связи (связи C-N) в белках образуют комплекс с Cu 2+ в биуретовом реагенте и дают фиолетовый цвет. Cu 2+ должен образовывать комплекс с четырьмя-шестью пептидными связями, чтобы получить цвет; следовательно, свободные аминокислоты не реагируют положительно. Длинные полипептиды (белки) имеют много пептидных связей и дают положительную реакцию на реагент. Биуретовый реагент представляет собой щелочной раствор 1% CuSO 4 , медный купорос. Фиолетовый цвет является положительным тестом на наличие белка, а интенсивность окраски пропорциональна количеству пептидных связей в растворе.
Биуретовый тест
- Изучите таблицу ниже.
 Укажите, является ли образец отрицательным контролем, положительным контролем или экспериментальным.
Укажите, является ли образец отрицательным контролем, положительным контролем или экспериментальным. - Предсказать изменение цвета раствора.
- Сформулируйте гипотезу о компонентах экспериментов.
- Возьмите 6 пробирок и пронумеруйте их от 1 до 6.
- Добавьте материалы, перечисленные в таблице.
- Добавьте 3 капли реагента Biuret (1,0% CuSO 4 с NaOH) в каждую пробирку и перемешайте.
- Запишите цвет содержимого пробирок в табл.
Выводы по образцам мочи
На основании результатов теста Бенедикта и биуретового теста можем ли мы сделать какие-либо выводы?
Эта страница под названием 2.9: Proteins распространяется под лицензией CC BY-NC-SA 4.0 и была создана, изменена и/или курирована Bio-OER.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Био-ОЭР
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Теги

Химия белковых анализов | Thermo Fisher Scientific
Большинство колориметрических методов анализа белков можно разделить на две группы в зависимости от типа используемого химического состава: методы, включающие комплексообразование белок-медь с вторичным обнаружением восстановленной меди, и методы, основанные на связывании белка с красителем с прямым обнаружением изменение цвета, связанное со связанным красителем.
Большинство коммерческих реагентов для анализа белков представляют собой хорошо охарактеризованные надежные продукты, дающие стабильные и надежные результаты. Тем не менее, каждый реагент для анализа имеет свои ограничения; базовое понимание химических процессов, связанных с каждым типом анализа, необходимо для выбора подходящего метода для данного образца и для правильной оценки результатов.
Наборы для анализа Explore BCA Наборы для анализа Explore Bradford Техническое руководство по анализу белков
Содержание страницы
- Химические анализы на основе меди
- Химические анализы на основе красителей
- Анализы флуоресцентных белков
Химические анализы на основе меди
Пептиды и биуретовая реакция
Анализы белков на основе меди, включая BCA и методы Лоури, основаны на хорошо известной «биуретовой реакции», при которой пептиды, содержащие три или более аминокислотных остатка, образуют окрашенный хелатный комплекс с медью. ионов (Cu2+) в щелочной среде, содержащей виннокислый натрий-калий. Это стало известно как биуретовая реакция, потому что она химически подобна комплексу, который образуется с органическим соединением биурета (Nh3-CO-NH-CO-Nh3) и ионом меди. Биурет, продукт избытка мочевины и тепла, реагирует с медью с образованием светло-голубого тетрадентатного комплекса.
ионов (Cu2+) в щелочной среде, содержащей виннокислый натрий-калий. Это стало известно как биуретовая реакция, потому что она химически подобна комплексу, который образуется с органическим соединением биурета (Nh3-CO-NH-CO-Nh3) и ионом меди. Биурет, продукт избытка мочевины и тепла, реагирует с медью с образованием светло-голубого тетрадентатного комплекса.
Рисунок 1. Схема биуретовой реакции. При восстановлении иона меди из формы меди в форму меди реакция дает слабый сине-фиолетовый цвет.
Рисунок 2. Структуры мочевины, биурета и пептида. Поскольку полипептиды имеют структуру, подобную биурету, они способны образовывать комплексы с медью в результате биуретовой реакции.
Отдельные аминокислоты и дипептиды не дают биуретовой реакции, но трипептиды и более крупные полипептиды или белки будут реагировать с образованием комплекса от светло-голубого до фиолетового, который поглощает свет при 540 нм. Один ион меди образует окрашенный координационный комплекс с четырьмя-шестью соседними пептидными связями. Интенсивность окрашивания пропорциональна количеству пептидных связей, участвующих в реакции. Таким образом, биуретовая реакция лежит в основе одноименного простого и быстрого колориметрического реагента для количественного определения концентрации общего белка. Рабочий диапазон для анализа биурета составляет 5–160 мг/мл, что достаточно для некоторых видов промышленного применения, но недостаточно чувствительно для большинства потребностей в исследованиях белков.
Интенсивность окрашивания пропорциональна количеству пептидных связей, участвующих в реакции. Таким образом, биуретовая реакция лежит в основе одноименного простого и быстрого колориметрического реагента для количественного определения концентрации общего белка. Рабочий диапазон для анализа биурета составляет 5–160 мг/мл, что достаточно для некоторых видов промышленного применения, но недостаточно чувствительно для большинства потребностей в исследованиях белков.
Анализы белка на бицинхониновую кислоту (BCA)
Анализ белка BCA был представлен Smith, et al., в 1985 году. С тех пор он стал самым популярным методом колориметрического обнаружения и количественного определения общего белка. Одним из особых преимуществ является то, что, в отличие от других методов, доступных в то время (например, анализы Брэдфорда и Лоури), анализ белка BCA совместим с образцами, которые содержат до 5% поверхностно-активных веществ (детергентов). Кроме того, анализ BCA более равномерно реагирует на различные белки, чем метод Брэдфорда.
Анализ белка BCA сочетает индуцированную белком биуретовую реакцию (см. выше) с высокочувствительным и селективным колориметрическим определением образующегося катиона меди (Cu1+) с помощью бицинхониновой кислоты (BCA). Таким образом, задействованы два шага. Во-первых, это биуретовая реакция, слабый синий цвет которой возникает в результате восстановления иона меди до иона меди. Во-вторых, это хелатирование BCA ионами меди, что приводит к интенсивному фиолетовому цвету. Продукт реакции фиолетового цвета образуется в результате хелатирования двух молекул BCA с одним ионом меди. Комплекс BCA/медь растворим в воде и демонстрирует сильное линейное поглощение при 562 нм при увеличении концентрации белка. Фиолетовый цвет можно измерить на любой длине волны от 550 до 570 нм с минимальной (менее 10%) потерей сигнала. Реактив BCA примерно в 100 раз более чувствителен (нижний предел обнаружения), чем биуретовый реагент.
Рисунок 3. Реакция БЦА с ионом меди. Две молекулы BCA связываются с каждой молекулой меди, которая была восстановлена в результате биуретовой реакции, опосредованной пептидами.
Реакция, которая приводит к образованию окраски BCA в результате восстановления Cu2+, особенно зависит от присутствия в белках трех конкретных аминокислотных остатков: цистеина/цистина, тирозина и триптофана. По-видимому, эти аминокислоты независимо усиливают восстановление меди в биуретовой реакции, вызывая тем самым образование окрашенного хелата BCA-Cu1+. Однако исследования, проведенные с ди- и трипептидами, показывают, что они производят больше цвета, чем можно объяснить четырьмя отдельными BCA-реактивными аминокислотами. Другими словами, пептидный скелет (и, следовательно, общее количество белка) вносит основной вклад в снижение содержания меди в биуретовой реакции и развитие окраски в анализе BCA. Незначительные межбелковые различия в анализе белков BCA являются результатом различий между белками в составе этих трех аминокислот.
Связывание BCA с ионом меди эффективно удаляет слабохелатированные пептиды биуретовой реакции. Затем эти пептидные группы могут связываться с другой молекулой иона двухвалентной меди. Следовательно, если бицинхониновая кислота и медь присутствуют в большом избытке (как они всегда присутствуют в реагентах для анализа белка BCA), анализ белка не достигает конечной точки. Кроме того, скорость образования цвета BCA зависит от температуры инкубации. Следовательно, ключ к получению точных результатов с помощью метода анализа BCA заключается в одновременном анализе стандартов и неизвестных образцов, чтобы они оба получали одинаковое время инкубации и температуру. Предполагая, что анализ проводится таким образом, характеристика анализа позволяет ускорить проявление или дольше ждать проявления желаемого цвета по мере необходимости.
Следовательно, если бицинхониновая кислота и медь присутствуют в большом избытке (как они всегда присутствуют в реагентах для анализа белка BCA), анализ белка не достигает конечной точки. Кроме того, скорость образования цвета BCA зависит от температуры инкубации. Следовательно, ключ к получению точных результатов с помощью метода анализа BCA заключается в одновременном анализе стандартов и неизвестных образцов, чтобы они оба получали одинаковое время инкубации и температуру. Предполагая, что анализ проводится таким образом, характеристика анализа позволяет ускорить проявление или дольше ждать проявления желаемого цвета по мере необходимости.
Вещества, восстанавливающие содержание меди, также вызывают окрашивание в анализе BCA, что влияет на точность количественного определения белка. Реагенты, которые хелатируют медь, также мешают, уменьшая количество цвета BCA, производимого белком. Определенные отдельные аминокислоты (цистеин или цистин, тирозин и триптофан) также вызывают окрашивание и мешают анализу АЦК. Технические советы и специализированные версии продуктов для анализа белка BCA решают ту или иную из этих проблем несовместимости образцов.
Технические советы и специализированные версии продуктов для анализа белка BCA решают ту или иную из этих проблем несовместимости образцов.
Последним достижением в колориметрическом анализе белка является анализ белка Pierce Rapid Gold BCA, который сохраняет высокую чувствительность и линейность традиционного анализа BCA, но дает готовые к считыванию результаты в течение 5 минут при инкубации при комнатной температуре (КТ). В противоположность этому, при использовании традиционных анализов BCA (в зависимости от протокола) время инкубации варьируется от 30 минут до 2 часов при температуре от 37 ₀ C до 60 ₀ C.
Как и традиционный анализ BCA, анализ Pierce Rapid Gold Анализ белков BCA включает восстановление меди белками в щелочной среде (биуретовая реакция) для получения чувствительного и селективного колориметрического обнаружения с помощью нового хелатора меди. Количество восстановленной меди пропорционально количеству белка, присутствующего в растворе. Селективный хелатор меди образует комплекс оранжево-золотистого цвета, который сильно поглощает свет при 480 нм. Эти репрезентативные данные сравнивают эффективность традиционных и недавно адаптированных анализов белка BCA.
Селективный хелатор меди образует комплекс оранжево-золотистого цвета, который сильно поглощает свет при 480 нм. Эти репрезентативные данные сравнивают эффективность традиционных и недавно адаптированных анализов белка BCA.
Рис. 4. Определение концентрации белка в лизатах с использованием стандартного анализа белка Pierce BCA и анализа белка Pierce Rapid Gold BCA. Оба анализа были проведены в соответствии с протоколами производителя в формате микропланшета. Для стандартного анализа BCA 25 мкл образца добавляли к 200 мкл рабочего реагента BCA и инкубировали в течение 30 минут при 37°C. Для анализа белков Pierce Rapid Gold BCA 20 мкл образца добавляли к 200 мкл рабочего реагента Pierce Rapid Gold BCA и инкубировали при комнатной температуре в течение 5 минут.
Анализы белка Лоури
Анализ белка Лоури назван в честь Оливера Х. Лоури, который разработал и представил его (Lowry, et al., 1951). Он предложил значительное улучшение по сравнению с предыдущими анализами белка, и его статья стала одной из самых цитируемых ссылок в литературе по наукам о жизни на многие годы. В модифицированном анализе белка Лоури используется стабильный реагент, который заменяет два нестабильных реагента, описанных Лоури. По сути, анализ представляет собой расширенный анализ биурета, включающий химию хелатирования меди.
В модифицированном анализе белка Лоури используется стабильный реагент, который заменяет два нестабильных реагента, описанных Лоури. По сути, анализ представляет собой расширенный анализ биурета, включающий химию хелатирования меди.
Хотя механизм формирования окраски для анализа Лоури аналогичен механизму анализа белка ВСА, между ними есть несколько существенных различий. Точный механизм образования окраски в анализе Лоури остается малоизученным. Анализ проводится в два отдельных этапа. Сначала белок подвергают реакции со щелочным сульфатом меди в присутствии тартрата в течение 10 минут при комнатной температуре. Во время этой инкубации образуется тетрадентатный комплекс меди из четырех пептидных связей и одного атома меди (это «биуретовая реакция»). Во-вторых, добавляют раствор фосфорно-молибденовой и фосфорно-вольфрамовой кислоты. Это соединение (называемое реагентом Фолин-фенол) восстанавливается, придавая ему интенсивный синий цвет. Считается, что усиление цвета происходит, когда тетрадентатный комплекс меди передает электроны комплексу фосфорно-молибденовой и фосфорно-вольфрамовой кислот. Синий цвет продолжает усиливаться в течение 30 минут инкубации при комнатной температуре. Было высказано предположение, что в течение 30 минут инкубации перегруппировка исходного нестабильного синего комплекса приводит к стабильному конечному комплексу синего цвета, который имеет более высокую абсорбцию (Lowry, et al. 19).51; Леглер и др. 1985).
Синий цвет продолжает усиливаться в течение 30 минут инкубации при комнатной температуре. Было высказано предположение, что в течение 30 минут инкубации перегруппировка исходного нестабильного синего комплекса приводит к стабильному конечному комплексу синего цвета, который имеет более высокую абсорбцию (Lowry, et al. 19).51; Леглер и др. 1985).
Окончательный синий цвет оптимально измеряется при 750 нм, но его можно измерить при любой длине волны от 650 до 750 нм с небольшой потерей интенсивности цвета. Лучше всего измерять цвет при длине волны 750 нм, так как немногие другие вещества поглощают свет с такой длиной волны.
Рис. 5. Сводка протокола модифицированного анализа белка Лоури.
Для небольших пептидов интенсивность окраски увеличивается с увеличением размера пептида. Присутствие любого из пяти аминокислотных остатков (тирозин, триптофан, цистеин, гистидин и аспарагин) в пептидной или белковой основе дополнительно усиливает количество производимого цвета, поскольку они вносят дополнительные восстанавливающие эквиваленты для дальнейшего восстановления комплекса фосфомолибденовой/фосфовольфрамовой кислоты. За исключением тирозина и триптофана, свободные аминокислоты не дают окрашенного продукта с реактивом Лоури; однако большинство дипептидов можно обнаружить. В отсутствие какой-либо из пяти аминокислот, перечисленных выше, в пептидном остове белки, содержащие остатки пролина, имеют более низкую цветовую реакцию с реактивом Лоури из-за того, что аминокислота препятствует образованию комплекса.
За исключением тирозина и триптофана, свободные аминокислоты не дают окрашенного продукта с реактивом Лоури; однако большинство дипептидов можно обнаружить. В отсутствие какой-либо из пяти аминокислот, перечисленных выше, в пептидном остове белки, содержащие остатки пролина, имеют более низкую цветовую реакцию с реактивом Лоури из-за того, что аминокислота препятствует образованию комплекса.
В отличие от анализа BCA, этап вторичного связывания в методе Лоури не включает отсоединение пептидно-медного хелата. Таким образом, метод Лоури фактически является анализом конечной точки. Хотя всегда лучше включать внутренние стандарты в любой анализ белка, можно получить разумные оценки белка с помощью этого метода анализа путем сравнения с предварительно построенной стандартной кривой.
Протокол требует, чтобы фенольный реагент Folin добавлялся в каждую пробирку точно в конце десятиминутной инкубации. При щелочном рН реактива Лоури фенольный реактив Фолина практически сразу инактивируется. Поэтому лучше всего добавлять фенольный реагент Folin в точное время, одновременно перемешивая каждую пробирку. Поскольку это несколько громоздко, для получения стабильных результатов требуется некоторая практика. Это также ограничивает общее количество образцов, которые можно анализировать за один цикл. Если используется десятисекундный интервал между пробирками, максимальное количество пробирок, которое можно проанализировать в течение десяти минут, равно шестидесяти (10 секунд/пробирка x 60 пробирок = 600 секунд или 10 минут).
Поэтому лучше всего добавлять фенольный реагент Folin в точное время, одновременно перемешивая каждую пробирку. Поскольку это несколько громоздко, для получения стабильных результатов требуется некоторая практика. Это также ограничивает общее количество образцов, которые можно анализировать за один цикл. Если используется десятисекундный интервал между пробирками, максимальное количество пробирок, которое можно проанализировать в течение десяти минут, равно шестидесяти (10 секунд/пробирка x 60 пробирок = 600 секунд или 10 минут).
Реактив Лоури образует осадок в присутствии детергентов или ионов калия. Когда причиной являются ионы калия, проблему иногда можно решить путем центрифугирования пробирки и измерения цвета надосадочной жидкости. Большинство поверхностно-активных веществ вызывают осаждение реагента даже при очень низких концентрациях. Единственным исключением является додецилсульфат натрия (SDS), который совместим с реагентом при концентрациях до 1% в образце. Хелатирующие агенты мешают связыванию меди и предотвращению образования комплекса медных пептидных связей. Восстанавливающие агенты и свободные тиолы также мешают восстановлению фосфовольфрамат-фосфомолибдатного комплекса, немедленно образуя при их добавлении продукт интенсивного синего цвета.
Восстанавливающие агенты и свободные тиолы также мешают восстановлению фосфовольфрамат-фосфомолибдатного комплекса, немедленно образуя при их добавлении продукт интенсивного синего цвета.
Модифицированный реагент Лоури для анализа белка должен храниться в холодильнике для длительного хранения, но перед использованием его необходимо нагреть до комнатной температуры. Использование холодного модифицированного реагента для анализа белка Лоури приведет к низким значениям абсорбции.
Химические анализы на основе красителей
Анализ белка на красителе Кумасси (Брэдфорд)
Использование красителя Кумасси G-250 в качестве колориметрического реагента для обнаружения и количественного определения общего белка было впервые описано доктором Мэрион Брэдфорд в 1976 (Брэдфорд, 1976). Анализы Thermo Scientific Pierce Coomassie (Bradford) представляют собой варианты реагента, о котором впервые сообщил Брэдфорд.
Рис. 6. Химическая структура красителя Кумасси. Эта коллоидная форма красителя Кумасси, приготовленная в буфере с фосфорной кислотой с низким pH, является основой для реагентов для анализа белков Брэдфорда.
Эта коллоидная форма красителя Кумасси, приготовленная в буфере с фосфорной кислотой с низким pH, является основой для реагентов для анализа белков Брэдфорда.
В кислой среде реагента белок связывается с красителем Кумасси. Это приводит к спектральному сдвигу от красновато-коричневой формы красителя (максимум поглощения при 465 нм) к синей форме красителя (максимум поглощения при 610 нм). Разница между двумя формами красителя наибольшая при 595 нм, так что это оптимальная длина волны для измерения синего цвета комплекса кумасси-белок. При желании синий цвет можно измерить при любой длине волны от 575 нм до 615 нм. На двух крайних значениях (575 нм и 615 нм) происходит потеря около 10% измеренного количества цвета (поглощения) по сравнению с полученным при 595 нм.
Развитие окраски в анализе белков по Бредфорду связано с присутствием в белке определенных основных аминокислот (в первую очередь аргинина, лизина и гистидина). Силы Ван-дер-Ваальса и гидрофобные взаимодействия также участвуют в связывании красителя белком. Количество лигандов красителя кумасси, связанных с каждой молекулой белка, приблизительно пропорционально количеству положительных зарядов, обнаруженных на белке. Свободные аминокислоты, пептиды и белки с низкой молекулярной массой не дают окрашивания реагентами красителя Кумасси. Как правило, масса пептида или белка должна быть не менее 3000 дальтон, чтобы его можно было обнаружить с помощью этого реагента. В некоторых приложениях это может быть преимуществом. Например, анализ белка кумасси использовался для измерения «белков с высокой молекулярной массой» во время ферментации в пивоваренной промышленности.
Количество лигандов красителя кумасси, связанных с каждой молекулой белка, приблизительно пропорционально количеству положительных зарядов, обнаруженных на белке. Свободные аминокислоты, пептиды и белки с низкой молекулярной массой не дают окрашивания реагентами красителя Кумасси. Как правило, масса пептида или белка должна быть не менее 3000 дальтон, чтобы его можно было обнаружить с помощью этого реагента. В некоторых приложениях это может быть преимуществом. Например, анализ белка кумасси использовался для измерения «белков с высокой молекулярной массой» во время ферментации в пивоваренной промышленности.
Анализы связывания красителя кумасси являются самыми быстрыми и простыми в выполнении из всех белковых анализов. Анализ проводится при комнатной температуре и не требует специального оборудования. Стандартные и неизвестные образцы добавляют в пробирки, содержащие предварительно приготовленный реагент для анализа Кумасси, и измеряют полученную синюю окраску при 595 нм после непродолжительной инкубации при комнатной температуре. Белковые анализы, содержащие краситель Кумасси, совместимы с большинством солей, растворителей, буферов, тиолов, восстанавливающих веществ и агентов, хелатирующих металлы, встречающихся в образцах белков.
Белковые анализы, содержащие краситель Кумасси, совместимы с большинством солей, растворителей, буферов, тиолов, восстанавливающих веществ и агентов, хелатирующих металлы, встречающихся в образцах белков.
Основным недостатком белковых анализов на основе кумасси является их несовместимость с поверхностно-активными веществами в концентрациях, обычно используемых для растворения мембранных белков. Как правило, присутствие поверхностно-активного вещества в образце даже при низких концентрациях вызывает осаждение реагента. Кроме того, реагент-краситель кумасси очень кислый, поэтому белки с плохой растворимостью в кислоте не могут быть проанализированы с помощью этого реагента. Наконец, реагенты Кумасси приводят к примерно вдвое большей вариации между белками, чем реагенты для анализа на основе хелатирования меди.
Рисунок 7. Спектры поглощения белковых стандартов в анализе белков Thermo Scientific Pierce Coomassie Plus (Bradford) . Стандарты белка: 0, 125, 250, 500, 750, 1000, 1500 и 2000 мкг/мл бычьего сывороточного альбумина соответственно. Линия 2000 мкг/мл нарисована толще других, чтобы ориентировать последовательность. Обратите внимание, что обратная зависимость между концентрацией белка и поглощением возникает ниже 525 нм (максимум при 465 нм).
Линия 2000 мкг/мл нарисована толще других, чтобы ориентировать последовательность. Обратите внимание, что обратная зависимость между концентрацией белка и поглощением возникает ниже 525 нм (максимум при 465 нм).
Готовые к использованию жидкие реагенты на основе красителя кумасси следует осторожно перемешать переворачиванием непосредственно перед использованием. Краситель в этих жидких реагентах образует рыхлые агрегаты в течение 60 минут в ненарушенных растворах. Аккуратное перемешивание реагента путем переворачивания бутыли обеспечивает равномерное распределение красителя и гомогенность аликвот. После связывания с белком краситель также образует агрегаты белок-краситель. К счастью, эти агрегаты белок-краситель можно легко диспергировать, перемешивая реакционную пробирку. Это характерно для всех жидких реагентов на основе красителя кумасси. Поскольку эти агрегаты образуются относительно быстро, также лучше регулярно перемешивать (встряхивать в течение 2-3 секунд) каждую пробирку или планшет непосредственно перед измерением цвета.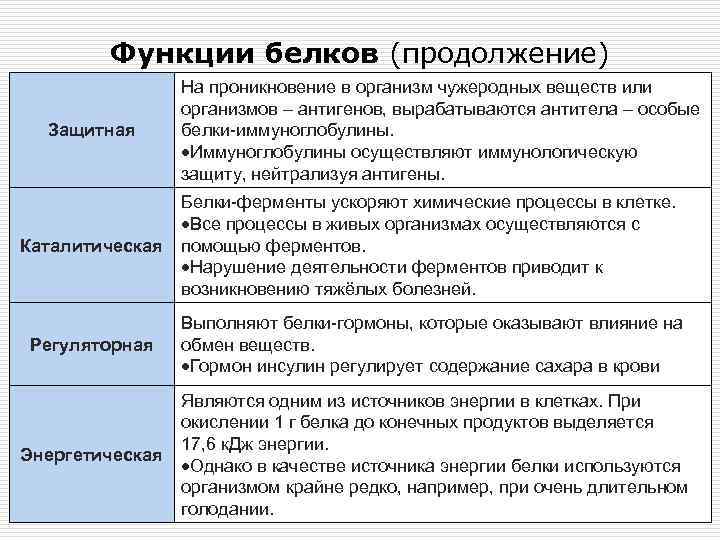
Анализ белка Пирса 660 нм
Представленный в 2008 году анализатор белка Thermo Scientific Pierce 660 нм представляет собой реагент на основе красителя, который обеспечивает такое же удобство, как анализы на основе кумасси, но устраняет некоторые из их недостатков. В частности, анализ Пирса 660 нм совместим с большинством моющих средств и дает более линейную кривую отклика.
Подробная химия анализа является собственностью компании, но основной механизм можно резюмировать следующим образом. Реагент содержит запатентованный комплекс краситель-металл в кислом буфере. Комплекс краситель-металл связывается с белком в кислой среде, вызывая сдвиг максимума поглощения красителя, который измеряется при 660 нм. Реактив имеет красновато-коричневый цвет и становится зеленым при связывании с белком.
Рис. 8. Максимум поглощения комплекса реагент-металл при 660 нм смещается пропорционально при связывании с БСА. Спектры поглощения были записаны для реагента для анализа белка Pierce 660 нм в диапазоне от 340 до 800 нм с использованием спектрофотометра. Белок в присутствии комплекса реагент-металл вызывает значительный сдвиг поглощения при длине волны 660 нм.
Белок в присутствии комплекса реагент-металл вызывает значительный сдвиг поглощения при длине волны 660 нм.
Цвет, полученный в результате анализа, стабилен и увеличивается пропорционально широкому диапазону возрастающих концентраций белка. Изменение цвета вызывается депротонированием красителя при низком pH, которому способствуют взаимодействия с белком через положительно заряженные аминокислотные группы и отрицательно заряженный депротонированный комплекс краситель-металл.
Анализ связывается с белками аналогично красителю Кумасси. Таким образом, он имеет сходную межбелковую изменчивость с методами анализа Кумасси (Брэдфорд). Однако, в отличие от анализов на основе кумасси, анализ белка Пирса 660 нм полностью совместим с неионогенными детергентами, обычно используемыми в образцах белка. Фактически, при использовании с реагентом совместимости с ионным детергентом (IDCR) анализ Пирса 660 нм также совместим с образцом, содержащим буфер образца Laemmli SDS с бромфеноловым синим и другими буферами, содержащими обычные ионные детергенты.
Анализы флуоресцентных белков
Методы количественного определения белка на основе флуоресценции обеспечивают превосходную чувствительность, а это означает, что для количественного определения используется меньше образца белка, что позволяет использовать больше образцов для экспериментов. Для анализов, описанных ниже, требуется несколько шагов, и время не имеет решающего значения, поскольку продолжительность сигнала обычно составляет несколько часов, поэтому анализы можно адаптировать для автоматизированной обработки в приложениях с высокой пропускной способностью. Сигнал флуоресценции можно обнаружить с помощью флуорометра или считывателя микропланшетов.
Флуоресцентные анализы белков обычно обеспечивают исследователям большую чувствительность, чем та, которую можно измерить с помощью колориметрических анализов белков. Анализы белков Thermo Scientific Quanti-iT, Qubit и NanoOrange основаны на связывании молекулы красителя с детергентным покрытием на белках и гидрофобных участках белков, что приводит к флуоресценции, в то время как несвязанный краситель не флуоресцирует. Длина волны обнаружения для всех трех анализов составляет 470/570 нм. Первые два дают квазилинейную стандартную кривую от 0,5 до 4 мкг в образце 200 мкл при объеме образца 1-20 мкл, в то время как NanoOrange имеет более низкий диапазон чувствительности 10 нг/мл, в пределах до 10 мкг/мл. мл. Для обнаружения липопротеинов или белков в сложной липидной среде можно использовать набор для количественного определения белков CBQCA. Эти репрезентативные данные показывают типичную стандартную кривую, полученную с использованием набора для анализа флуоресцентного белка.
Длина волны обнаружения для всех трех анализов составляет 470/570 нм. Первые два дают квазилинейную стандартную кривую от 0,5 до 4 мкг в образце 200 мкл при объеме образца 1-20 мкл, в то время как NanoOrange имеет более низкий диапазон чувствительности 10 нг/мл, в пределах до 10 мкг/мл. мл. Для обнаружения липопротеинов или белков в сложной липидной среде можно использовать набор для количественного определения белков CBQCA. Эти репрезентативные данные показывают типичную стандартную кривую, полученную с использованием набора для анализа флуоресцентного белка.
Рис. 9. Низкая межбелковая вариация в тесте Qubit Protein Assay.
Набор NanoOrange Protein Quantitation Kit содержит очень чувствительный и простой анализ для количественного определения белка с обнаружением всего 10 нг/мл белка в растворе. Этот флуоресцентный краситель подходит для использования со спектрофлуориметрами и ридерами микропланшетов. Для обнаружения липопротеинов или белков в сложной липидной среде воспользуйтесь нашим набором для количественного анализа белков CBQCA.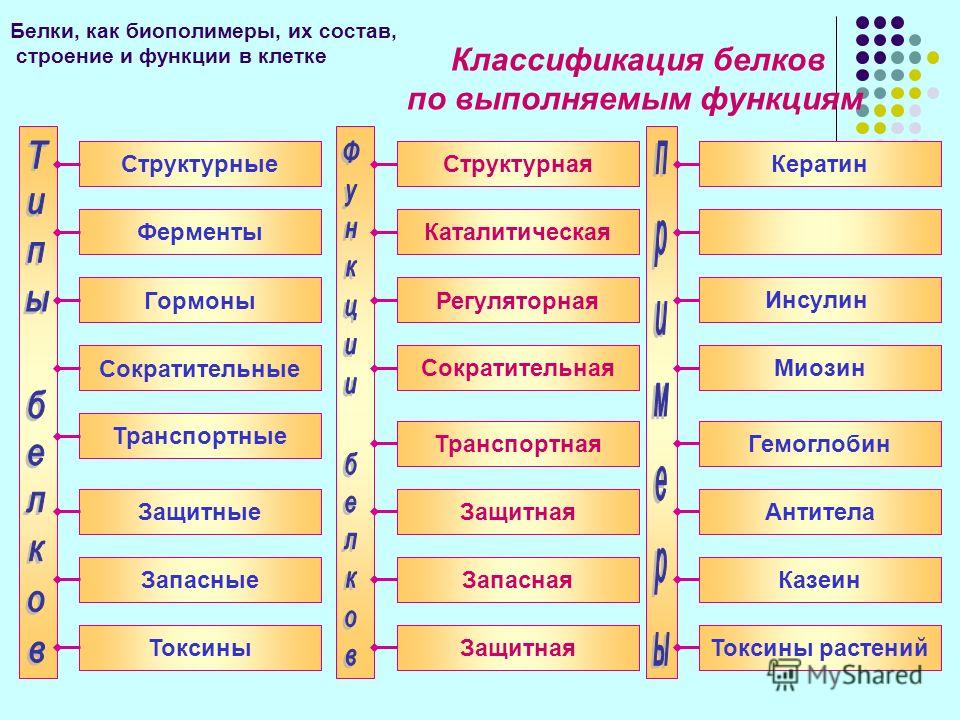
Набор для количественного определения белков CBQCA — это очень чувствительный анализ для количественного определения белков в растворе, способный обнаруживать до 10 нг белка на мл. Сходный по чувствительности с нашим реагентом для количественного определения белка NanoOrange (N-6666), CBQCA лучше подходит для точного количественного определения белков в присутствии липидов, мембранных фракций или детергентов, а также для липопротеинов и малых пептидов. Этот анализ основан на реакции красителя с первичными аминогруппами в присутствии цианида или тиолов, в результате чего он становится флуоресцентным. Непрореагировавший краситель остается нефлуоресцентным. Этот анализ белка может обнаруживать белки в диапазоне от 10 нг/мл до 150 мкг/мл.
Наконец, набор EZQ Protein Quantitation Kit обеспечивает анализ белка на основе флуоресценции, который облегчает быстрый количественный анализ образцов белка, подготовленных для гель-электрофореза. Анализ основан на электростатическом связывании красителя с основными аминокислотами, дополненном дополнительными гидрофобными взаимодействиями, что приводит к флуоресценции, которую можно считывать при 280 нм и 450/618 нм.
Обнаружение методом флуоресцентного анализа белка
Флуорометры — это приборы, которые измеряют интенсивность флуоресцентного сигнала от красителей, прикрепленных к биологическим молекулам, а также от естественных флуоресцентных молекул на основе сигнатурных длин волн возбуждения (Ex) и излучения (Em). Флуорометры были разработаны для количественного определения, обнаружения и мониторинга аналитов и их реакций с высокой степенью чувствительности и специфичности.
Флуорометр Invitrogen Qubit представляет собой настольное устройство, которое точно измеряет ДНК, РНК и белок с использованием высокочувствительных количественных анализов Qubit. В сочетании с оптимизированными алгоритмами флуорометр Qubit 3 использует флуоресцентные красители, которые производят сигнал только при связывании с интересующей мишенью, тем самым сводя к минимуму влияние загрязняющих веществ, включая деградировавшую ДНК или РНК, на экспериментальные результаты.
Рекомендуемое чтение
- Брэдфорд, штат Массачусетс.



 Укажите, является ли образец отрицательным контролем, положительным контролем или экспериментальным.
Укажите, является ли образец отрицательным контролем, положительным контролем или экспериментальным.
