Содержание
Углеводы. Классификация, функции. | Презентации Биология
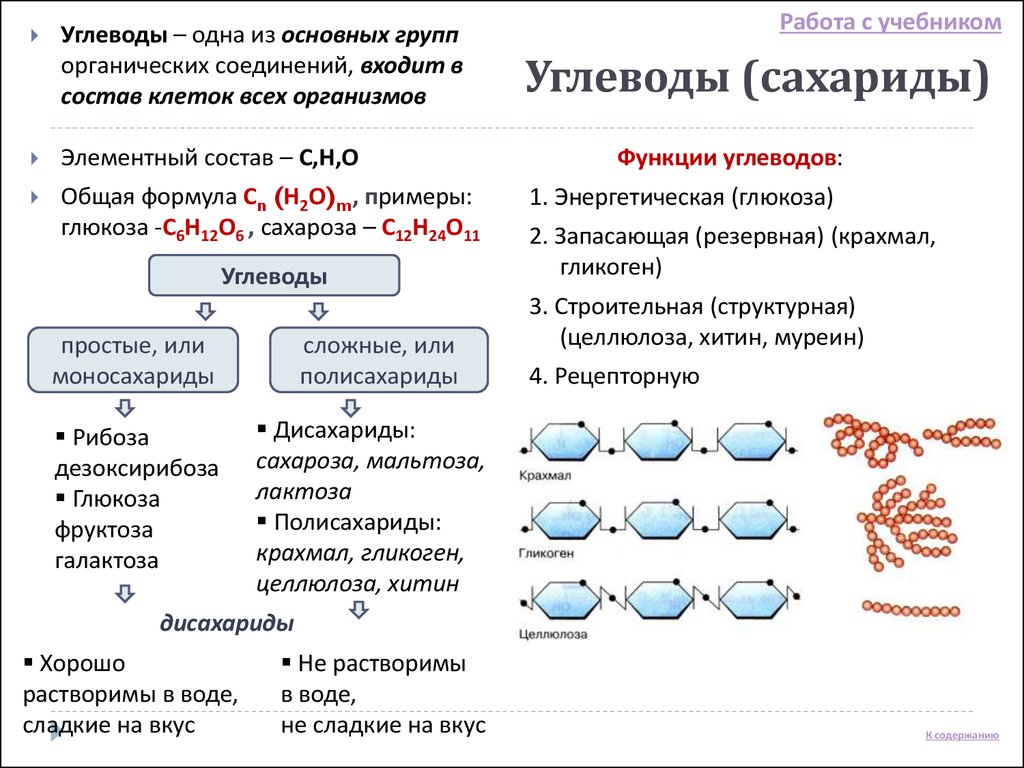
Скачай Углеводы. Классификация, функции. и еще Презентации в формате PDF Биология только на Docsity! Углеводы. Классификация , функции. Содержание: • Биологическая роль углеводов • Строение и классификация углеводов • Наиболее распространенные углеводы в живой природе Откуда берутся «углеводы»? Фотосинтез — первичный источник простых сахаров: В растениях на долю углеводов приходится 80 – 90 % сухой массы, у животных – около 2 % массы тела. Их синтез из углекислого газа и воды осуществляется зелеными растениями с использованием энергии солнечного света (фотосинтез). Фотосинтез xCO2 + yh3O +Солнечная энергия Cx(h3O)y углеводы + xO2 Метаболизм xCO2 + yh3O + ЭнергияCx(h3O)y углеводы + xO2 Биологические функции углеводов Пластическая функция Источником всех углеводов является процесс фотосинтеза в растениях и других фотосинтезирующих организмах. В результате фотосинтеза образуются простые сахара, которые служат исходными соединениями для биосинтеза разнообразных полисахаридов, а также веществ других классов (аминокислот, жирных кислот, полифенолов и т. д.). В животных клетках моносахариды образуются за счет распада поступающих с пищей полисахаридов. Структурная функция Полисахариды, например целлюлоза и хитин, входят в состав клеточных стенок, хитинового панциря членистоногих. Также полисахариды являются неотъемлемыми компонентами соединительной ткани животных (хрящи, сухожилия и др.). входят в состав ДНК РНК Защитная функция Защитную функцию выполняет гепарин. Этот углевод, являясь ингибитором свертывания крови, предотвращает образование тромбов. Он содержится в крови и соединительной ткани млекопитающих. Клеточные стенки бактерий, образованные полисахаридами, скреплены короткими аминокислотными цепочками, защищают бактериальные клетки от неблагоприятных воздействий. Углеводы участвуют у ракообразных и насекомых в построение наружного скелета, выполняющего защитную функцию, у растений шипы образуются из мертвых клеток, в клеточных стенках которых содержится много целлюлозы. Регуляторная функция Клетчатка (целлюлоза) – полисахарид, компонент растительных тканей, усиливает перистальтику кишечника, улучшая этим пищеварение, создает чувство насыщения; является субстратом для бактерий желудочно-кишечного тракта, синтезирующих витамины группы В; участвует в формировании каловых масс; способствует адсорбции токсических веществ в толстом кишечнике и их выведению, что снижает риск развития злокачественных новообразований толстого кишечника.
д.). В животных клетках моносахариды образуются за счет распада поступающих с пищей полисахаридов. Структурная функция Полисахариды, например целлюлоза и хитин, входят в состав клеточных стенок, хитинового панциря членистоногих. Также полисахариды являются неотъемлемыми компонентами соединительной ткани животных (хрящи, сухожилия и др.). входят в состав ДНК РНК Защитная функция Защитную функцию выполняет гепарин. Этот углевод, являясь ингибитором свертывания крови, предотвращает образование тромбов. Он содержится в крови и соединительной ткани млекопитающих. Клеточные стенки бактерий, образованные полисахаридами, скреплены короткими аминокислотными цепочками, защищают бактериальные клетки от неблагоприятных воздействий. Углеводы участвуют у ракообразных и насекомых в построение наружного скелета, выполняющего защитную функцию, у растений шипы образуются из мертвых клеток, в клеточных стенках которых содержится много целлюлозы. Регуляторная функция Клетчатка (целлюлоза) – полисахарид, компонент растительных тканей, усиливает перистальтику кишечника, улучшая этим пищеварение, создает чувство насыщения; является субстратом для бактерий желудочно-кишечного тракта, синтезирующих витамины группы В; участвует в формировании каловых масс; способствует адсорбции токсических веществ в толстом кишечнике и их выведению, что снижает риск развития злокачественных новообразований толстого кишечника. Углеводы — органические вещества, состоящие из углерода, водорода и кислорода. Альдегиды и кетоны многоатомных спиртов и их полимеры Все углеводы состоят из отдельных «единиц», которыми являются сахариды. По способности к гидролизу на мономеры углеводы делятся на две группы: простые и сложные. Углеводы, содержащие одну единицу, называются моносахариды, две единицы — дисахариды, от двух до десяти единиц — олигосахариды, а более десяти — полисахариды. Углеводы Простые (моносахариды) Сложные (полисахариды) Олигосахариды Полисахариды Глюкоза Фруктоза Рибоза С6Н12О6 (не гидролизируются) Сахароза Лактоза С12Н22О11 (гидролизируются с образованием 2-10 молекул моносахаридов) Крахмал Целлюлоза Гликоген (С6Н10О5)n (гидролизируются с образованием 10 и более молекул моносахаридов) Классификация углеводов Моносахариды По химической природе глюкоза фруктоза галактоза С6 — гексозы рибоза дезоксирибоза С5 — пентозы По числу атомов С Альдегиды ← Оксогруппа → Кетоны Альдоза [ альдегид + оза] Кетоза [ кетон + оза] 3 — триозы, 4 – тетрозы, 5 – пентозы и т.
Углеводы — органические вещества, состоящие из углерода, водорода и кислорода. Альдегиды и кетоны многоатомных спиртов и их полимеры Все углеводы состоят из отдельных «единиц», которыми являются сахариды. По способности к гидролизу на мономеры углеводы делятся на две группы: простые и сложные. Углеводы, содержащие одну единицу, называются моносахариды, две единицы — дисахариды, от двух до десяти единиц — олигосахариды, а более десяти — полисахариды. Углеводы Простые (моносахариды) Сложные (полисахариды) Олигосахариды Полисахариды Глюкоза Фруктоза Рибоза С6Н12О6 (не гидролизируются) Сахароза Лактоза С12Н22О11 (гидролизируются с образованием 2-10 молекул моносахаридов) Крахмал Целлюлоза Гликоген (С6Н10О5)n (гидролизируются с образованием 10 и более молекул моносахаридов) Классификация углеводов Моносахариды По химической природе глюкоза фруктоза галактоза С6 — гексозы рибоза дезоксирибоза С5 — пентозы По числу атомов С Альдегиды ← Оксогруппа → Кетоны Альдоза [ альдегид + оза] Кетоза [ кетон + оза] 3 — триозы, 4 – тетрозы, 5 – пентозы и т. д. CHO Ch3OH OHH Ch3OH Ch3OH O* Глицеральдегид (альдотриоза) Диоксиацетон (кетотриоза) ← ← сн,он у сн,он сн,он сн.он
д. CHO Ch3OH OHH Ch3OH Ch3OH O* Глицеральдегид (альдотриоза) Диоксиацетон (кетотриоза) ← ← сн,он у сн,он сн,он сн.он
Ан
„ Н о-глюкозы
чи Пыспаоюсоты
В-ывльтоза мальтола
(циклическая полу {пльлегидная форма)
ацстальная форма)
Циклическое изображение моносахаридов называется
перспективной формулой Хеуорса.
Представители моносахаридов •Глюкоза – главный источник энергии для практически всех клеток живых организмов. Глюкоза содержится во многих семенах и ягодах и необходим для снабжения организма энергией и образования гликогена в печени. •Фруктоза – углевод, содержащийся во фруктах и ягодах. Для расщепления фруктозы не требуется гормон инсулин для абсорбции, это позволяет использовать ее в ограниченных количествах при диабете. Содержится в сахарозе, кондитерских изделиях, джемах, мороженом, сладких соках, а также в свекле, персиках, моркови, сладкой сливе и других фруктах и овощах. В кишечнике сахароза расщепляется на фруктозу и глюкозу. •Рибоза и дезоксирибоза – являются структурными компонентами молекул РНК и ДНК. ГЛЮКОЗА
ГЛЮКОЗА
я
о
©
к
Н
ю-
<-
вы
тв
ра
а
О
Н
О]
О!
о
ЗЕ
Н
11
сон
Я
Н
ОНН
ОН
н он
ФРУКТОЗА
ы Са|асфозе
н-он
<-0 0 ин
но-с-н
н-с-он Н—С—онН
н-С-он нон
т ОВ Г но—с—н
Н
И н—с—он
ОНСН» СН2ОН СН, О, нон
Н ино ОН и В рва
ОНН
Глюкоза Фруктоза
носн, О он
ДИСАХАРИДЫ
и -ТАНАВЛИ
СХЕМА ОБРАЗОВАНИЯ
Н Н Н Н
®. 4’. ©
Воры
мер-: В.И
пактоса [мопечныхй сякар) —
Представители дисахардов Лактоза – молочный сахар, содержится в молочных продуктах. Врожденный или приобретенный дефицит фермента лактозы нарушает расщепление лактозы на глюкозу и галактозу в кишечнике, что приводит к неблагоприятному воздействию молочных продуктов на некоторых людей. Сахароза — это дисахарид, содержащийся в винограде и других фруктах, с формулой C12h32O11. Сахароза состоит из остатков глюкозы и фруктозы. Сахароза содержится в моркови, дыне, кленовом и березовом соке, сахарной свекле и сахарном тростнике. Сахароза – важный углевод, который мы потребляем ежедневно. Полисахариды 1) Гомополисахариды (крахмал, целлюлоза, пектиновые вещества, гликоген, хитин, декстраны) 2) Гетерополисахариды (гиалуроновая кислота, хондроитинсульфаты, кератансульфаты, гепарин, сиаловые кислоты) Полисахариды Гликоген –служит основной запасный углевод и основная форма хранения глюкозы в клетках животных.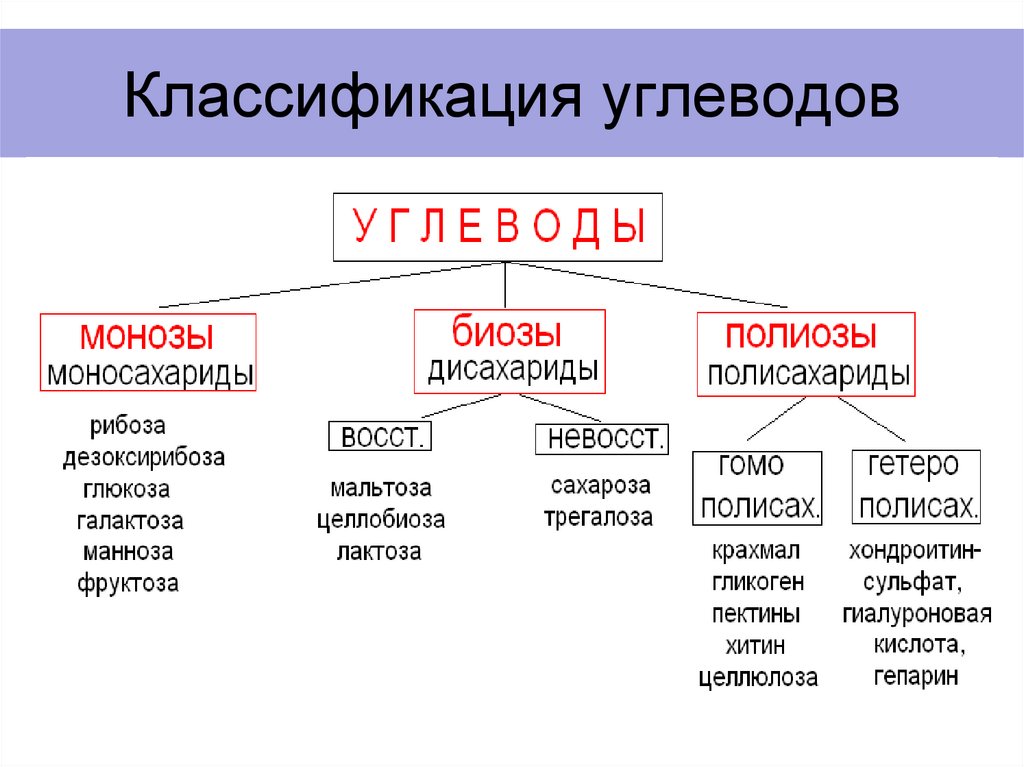 Откладывается в виде гранул в цитоплазме в клетках многих типов. ХИТИН, высокомол. линейный полисахарид, построенный из остатков N-ацетил- -D-глюкозамина с 1 4-связями между ними (см. ф-лу). Деацетилированные (частично или полностью) полимеры, встречающиеся в природе или получаемые хим. обработкой хитина, носят назв. хитозанов. Полисахариды Углеводы Углеводы должны составлять 40% от общего дневного рационаУглеводы должны составлять 40% от общего дневного рациона Углеводы Углеводы При нехватке углеводов организм начинает использовать энергетический потенциал белков и жиров, что увеличивает их расщепление и выделение вредных веществ в организм. При нехватке углеводов организм начинает использовать энергетический потенциал белков и жиров, что увеличивает их расщепление и выделение вредных веществ в организм. КлассификацияКлассификация Сложные углеводы – олигосахариды, полисахариды Сложные углеводы – олигосахариды, полисахариды Простые углеводы — моносахариды Простые углеводы — моносахариды Есть 2 функциональные группы: 1) гидроксильная группа со структурной формулой -ОН 2) карбонильная группа со структурной формулой -HC = O.
Откладывается в виде гранул в цитоплазме в клетках многих типов. ХИТИН, высокомол. линейный полисахарид, построенный из остатков N-ацетил- -D-глюкозамина с 1 4-связями между ними (см. ф-лу). Деацетилированные (частично или полностью) полимеры, встречающиеся в природе или получаемые хим. обработкой хитина, носят назв. хитозанов. Полисахариды Углеводы Углеводы должны составлять 40% от общего дневного рационаУглеводы должны составлять 40% от общего дневного рациона Углеводы Углеводы При нехватке углеводов организм начинает использовать энергетический потенциал белков и жиров, что увеличивает их расщепление и выделение вредных веществ в организм. При нехватке углеводов организм начинает использовать энергетический потенциал белков и жиров, что увеличивает их расщепление и выделение вредных веществ в организм. КлассификацияКлассификация Сложные углеводы – олигосахариды, полисахариды Сложные углеводы – олигосахариды, полисахариды Простые углеводы — моносахариды Простые углеводы — моносахариды Есть 2 функциональные группы: 1) гидроксильная группа со структурной формулой -ОН 2) карбонильная группа со структурной формулой -HC = O.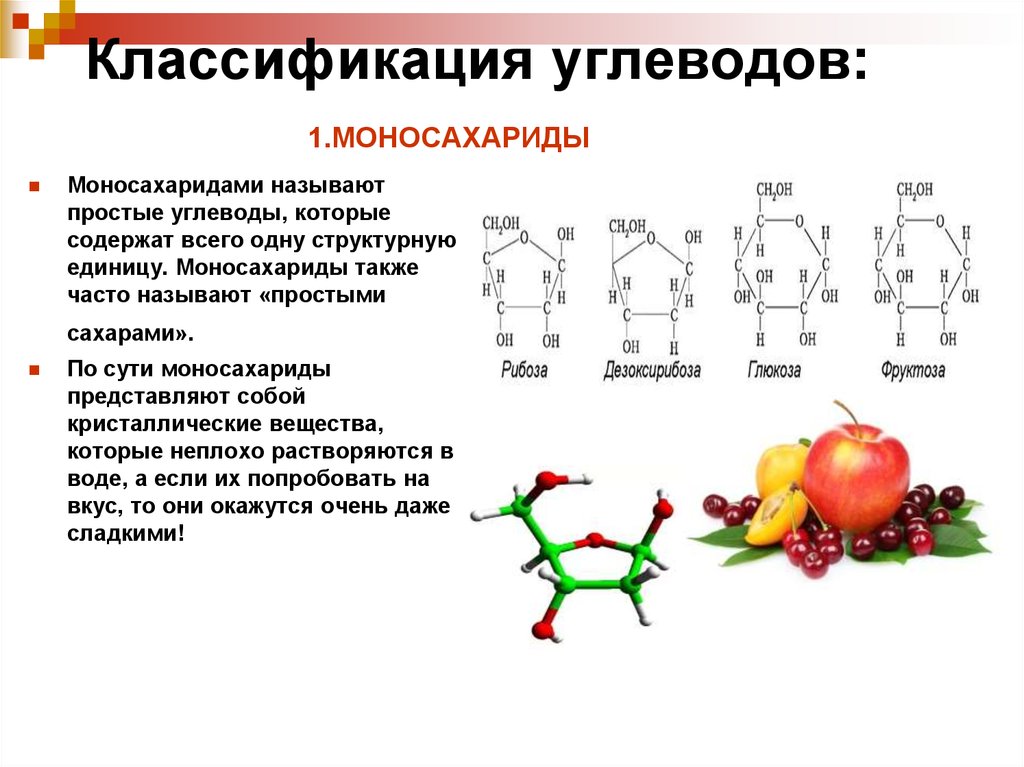 Есть 2 функциональные группы: 1) гидроксильная группа со структурной формулой -ОН 2) карбонильная группа со структурной формулой -HC = O. Высокий уровень углеводов в рационе вреден и приводит к ожирению. Чрезмерное потребление сахара отрицательно сказывается на функционировании микрофлоры кишечника, приводит к нарушению обмена холестерина и повышению его уровня в сыворотке крови. Высокий уровень углеводов в рационе вреден и приводит к ожирению. Чрезмерное потребление сахара отрицательно сказывается на функционировании микрофлоры кишечника, приводит к нарушению обмена холестерина и повышению его уровня в сыворотке крови. глюкоза С6h22O6 глюкоза С6h22O6 При окислении глюкозы образуется СО2 газы и Н2О, выделяется энергия (1 г. углеводов = 17,6 кДж = 4,1 ккал.) При окислении глюкозы образуется СО2 газы и Н2О, выделяется энергия (1 г. углеводов = 17,6 кДж = 4,1 ккал.)
Есть 2 функциональные группы: 1) гидроксильная группа со структурной формулой -ОН 2) карбонильная группа со структурной формулой -HC = O. Высокий уровень углеводов в рационе вреден и приводит к ожирению. Чрезмерное потребление сахара отрицательно сказывается на функционировании микрофлоры кишечника, приводит к нарушению обмена холестерина и повышению его уровня в сыворотке крови. Высокий уровень углеводов в рационе вреден и приводит к ожирению. Чрезмерное потребление сахара отрицательно сказывается на функционировании микрофлоры кишечника, приводит к нарушению обмена холестерина и повышению его уровня в сыворотке крови. глюкоза С6h22O6 глюкоза С6h22O6 При окислении глюкозы образуется СО2 газы и Н2О, выделяется энергия (1 г. углеводов = 17,6 кДж = 4,1 ккал.) При окислении глюкозы образуется СО2 газы и Н2О, выделяется энергия (1 г. углеводов = 17,6 кДж = 4,1 ккал.)
Строение, примеры и функции углеводов
Строение, примеры и функции углеводов
Углеводы — органические соединения, состав которых в большинстве случаев выражается общей формулой Cn(H2O)m (n и m ≥ 4). Углеводы подразделяются на моносахариды, олигосахариды и полисахариды.
Углеводы подразделяются на моносахариды, олигосахариды и полисахариды.
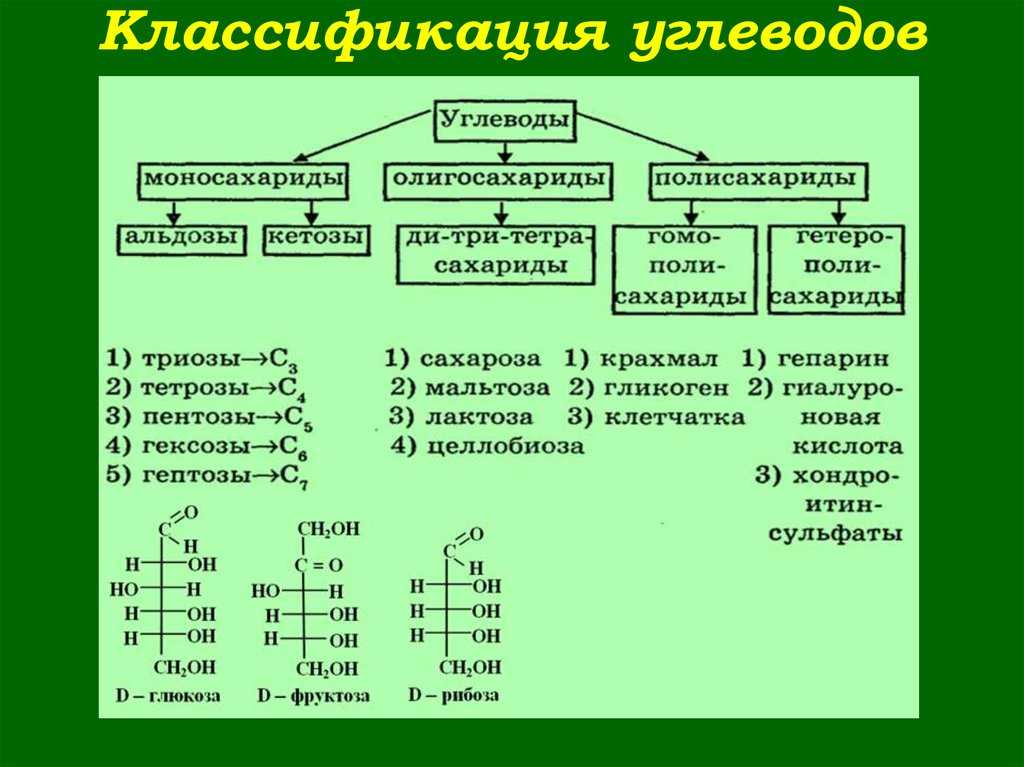
Моносахариды — простые углеводы, в зависимости от числа атомов углерода подразделяются на триозы (3), тетрозы (4), пентозы (5), гексозы (6) и гептозы (7 атомов). Наиболее распространены пентозы и гексозы.
Свойства моносахаридов — легко растворяются в воде, кристаллизуются, имеют сладкий вкус, могут быть представлены в форме α- или β-изомеров.
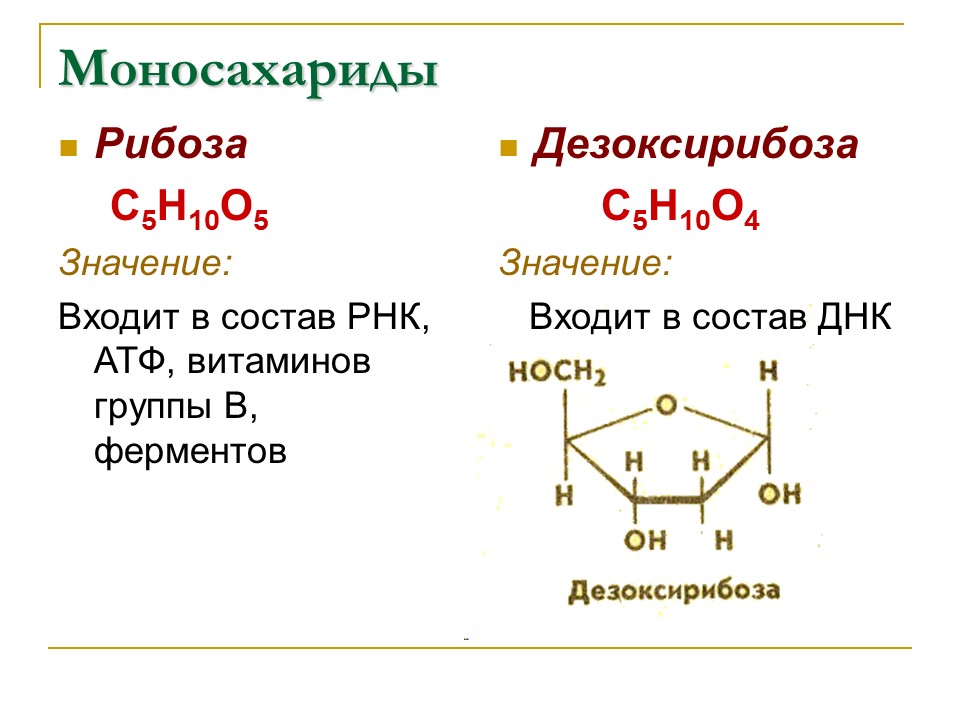
Рибоза и дезоксирибоза относятся к группе пентоз, входят в состав нуклеотидов РНК и ДНК, рибонуклеозидтрифосфатов и дезоксирибонуклеозидтрифосфатов и др. Дезоксирибоза (С5Н10О4) отличается от рибозы (С5Н10О5) тем, что при втором атоме углерода имеет атом водорода, а не гидроксильную группу, как у рибозы.
Глюкоза, или виноградный сахар (С6Н12О6), относится к группе гексоз, может существовать в виде α-глюкозы или β-глюкозы. Отличие между этими пространственными изомерами заключается в том, что при первом атоме углерода у α-глюкозы гидроксильная группа расположена под плоскостью кольца, а у β-глюкозы — над плоскостью.
Отличие между этими пространственными изомерами заключается в том, что при первом атоме углерода у α-глюкозы гидроксильная группа расположена под плоскостью кольца, а у β-глюкозы — над плоскостью.
Глюкоза — это:
один из самых распространенных моносахаридов,
важнейший источник энергии для всех видов работ, происходящих в клетке (эта энергия выделяется при окислении глюкозы в процессе дыхания),
мономер многих олигосахаридов и полисахаридов,
необходимый компонент крови.
Фруктоза, или фруктовый сахар, относится к группе гексоз, слаще глюкозы, в свободном виде содержится в меде (более 50%) и фруктах. Является мономером многих олигосахаридов и полисахаридов.
Олигосахариды — углеводы, образующиеся в результате реакции конденсации между несколькими (от двух до десяти) молекулами моносахаридов. В зависимости от числа остатков моносахаридов различают дисахариды, трисахариды и т.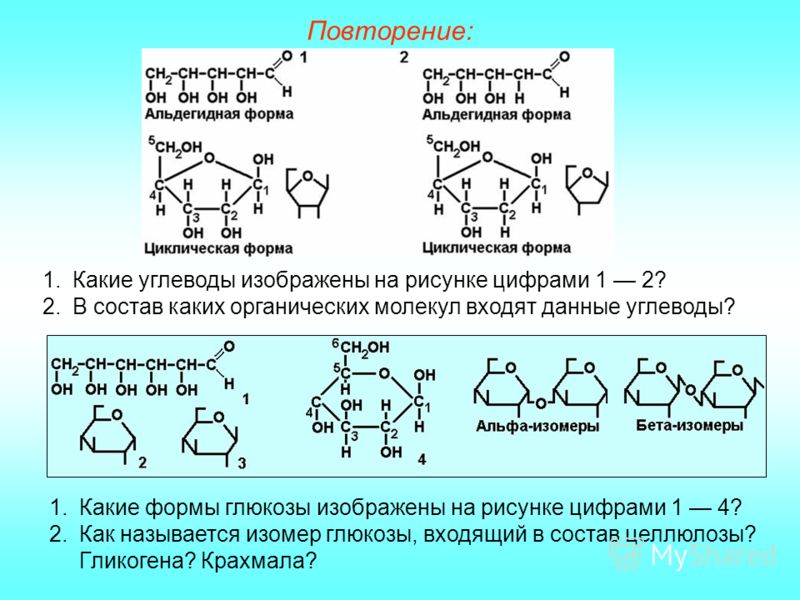 д. Наиболее распространены дисахариды. Свойства олигосахаридов — растворяются в воде, кристаллизуются, сладкий вкус уменьшается по мере увеличения числа остатков моносахаридов. Связь, образующаяся между двумя моносахаридами, называется гликозидной.
д. Наиболее распространены дисахариды. Свойства олигосахаридов — растворяются в воде, кристаллизуются, сладкий вкус уменьшается по мере увеличения числа остатков моносахаридов. Связь, образующаяся между двумя моносахаридами, называется гликозидной.
Сахароза, или тростниковый, или свекловичный сахар, — дисахарид, состоящий из остатков глюкозы и фруктозы. Содержится в тканях растений. Является продуктом питания (бытовое название — сахар). В промышленности сахарозу вырабатывают из сахарного тростника (стебли содержат 10–18%) или сахарной свеклы (корнеплоды содержат до 20% сахарозы).
Мальтоза, или солодовый сахар, — дисахарид, состоящий из двух остатков глюкозы. Присутствует в прорастающих семенах злаков.
Лактоза, или молочный сахар, — дисахарид, состоящий из остатков глюкозы и галактозы. Присутствует в молоке всех млекопитающих (2–8,5%).
Полисахариды — это углеводы, образующиеся в результате реакции поликонденсации множества (несколько десятков и более) молекул моносахаридов. Свойства полисахаридов — не растворяются или плохо растворяются в воде, не образуют ясно оформленных кристаллов, не имеют сладкого вкуса.
Свойства полисахаридов — не растворяются или плохо растворяются в воде, не образуют ясно оформленных кристаллов, не имеют сладкого вкуса.
Крахмал (С6Н10О5)n — полимер, мономером которого является α-глюкоза. Полимерные цепочки крахмала содержат разветвленные (амилопектин, 1,6-гликозидные связи) и неразветвленные (амилоза, 1,4-гликозидные связи) участки. Крахмал — основной резервный углевод растений, является одним из продуктов фотосинтеза, накапливается в семенах, клубнях, корневищах, луковицах. Содержание крахмала в зерновках риса — до 86%, пшеницы — до 75%, кукурузы — до 72%, в клубнях картофеля — до 25%.
Крахмал — основной углевод пищи человека (пищеварительный фермент — амилаза).
Гликоген (С6Н10О5)n — полимер, мономером которого также является α-глюкоза. Полимерные цепочки гликогена напоминают амилопектиновые участки крахмала, но в отличие от них ветвятся еще сильнее. Гликоген — основной резервный углевод животных, в частности, человека. Накапливается в печени (содержание — до 20%) и мышцах (до 4%), является источником глюкозы.
Гликоген — основной резервный углевод животных, в частности, человека. Накапливается в печени (содержание — до 20%) и мышцах (до 4%), является источником глюкозы.
Целлюлоза (С6Н10О5)n — полимер, мономером которого является β-глюкоза. Полимерные цепочки целлюлозы не ветвятся (β-1,4-гликозидные связи). Основной структурный полисахарид клеточных стенок растений. Содержание целлюлозы в древесине — до 50%, в волокнах семян хлопчатника — до 98%. Целлюлоза не расщепляется пищеварительными соками человека, т.к. у него отсутствует фермент целлюлаза, разрывающий связи между β-глюкозами.
Инулин — полимер, мономером которого является фруктоза. Резервный углевод растений семейства Сложноцветные.
Гликолипиды — комплексные вещества, образующиеся в результате соединения углеводов и липидов.
Строение крахмала
Крахмал состоит из 2 полисахаридов, построенных из остатков циклической a-глюкозы.
Как видно, соединение молекул глюкозы происходит с участием наиболее реакционноспособных гидроксильных групп, а исчезновение последних исключает возможность образования альдегидных групп, и они в молекуле крахмала отсутствуют. Поэтому крахмал не дает реакцию «серебряного зеркала».
Крахмал состоит не только из линейных молекул, но и из молекул разветвленной структуры. Этим объясняется зернистое строение крахмала.
В состав крахмала входят:
амилоза (внутренняя часть крахмального зерна) — 10-20%;
амилопектин (оболочка крахмального зерна) — 80-90%.
Амилоза
Амилоза растворима в воде и представляет собой линейный полимер, в котором остатки α–глюкозы связаны друг с другом через первый и четвертый атомы углерода (α-1,4-гликозидными связями).
Цепь амилозы включает 200 — 1000 остатков a-глюкозы (средняя мол.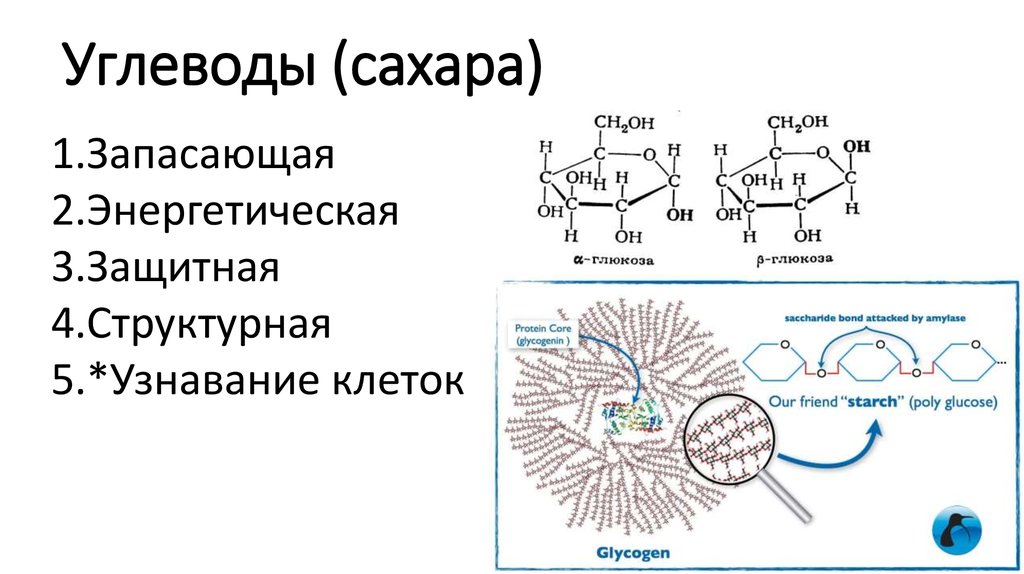 масса 160 000) .
масса 160 000) .
Макромолекула амилозы представляет собой спираль, каждый виток которой состоит из 6 звеньев a-глюкозы.
Амилопектин
В отличие от амилозы, амилопектин не растворим в воде, и имеет разветвленное строение.
Подавляющее большинство глюкозных остатков в амилопектине связаны, как и в амилозе α-1,4-гликозидными связями. Однако в точках разветвлений цепи имеются α-1,6-гликозидные связи.
Молекулярная масса амилопектина достигает 1-6 млн.
Молекулы амилопектина также довольно компактны, так как имеют сферическую форму.
Биологическая роль крахмала. Гликоген
Крахмал – главное запасное питательное вещество растений, основной источник резервной энергии в растительных клетках.
Остатки глюкозы в молекулах крахмала соединены достаточно прочно и в то же время под действием ферментов легко могут отщепляться, как только возникает потребность в источнике энергии.
Амилоза и амилопектин гидролизуются под действием кислот или ферментов до глюкозы, которая служит непосредственным источником энергии для клеточных реакций, входит в состав крови и тканей, участвует в обменных процессах.
Гликоген (животный крахмал) – полисахарид, молекулы которого построены из большого числа остатков α–глюкозы. Он имеет сходное строение с амилопектином, но отличается от него большей разветвленностью цепей, а также большей молекулярной массой.
Содержится гликоген главным образом в печени и в мышцах.
Гликоген – белый аморфный порошок, хорошо растворяется даже в холодной воде, легко гидролизуется под действием кислот и ферментов, образуя в качестве промежуточных веществ декстрины, мальтозу и при полном гидролизе – глюкозу.
Превращение крахмала в организме человека и животных
Нахождение в природе
Крахмал широко распространен в природе.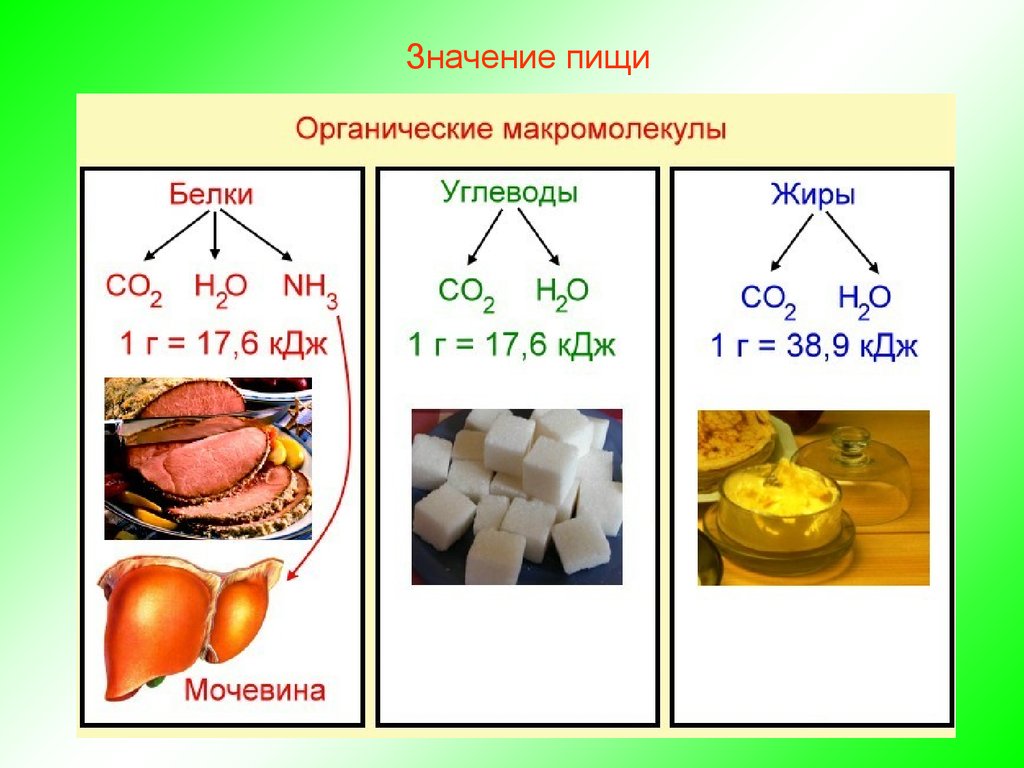 Он образуется в растениях в процессе фотосинтезе и накапливается в клубнях, корнях, семенах, а также в листьях и стеблях.
Он образуется в растениях в процессе фотосинтезе и накапливается в клубнях, корнях, семенах, а также в листьях и стеблях.
Крахмал содержится в растениях в виде крахмальных зерен. Наиболее богато крахмалом зерно злаков: риса (до 80%), пшеницы (до 70%), кукурузы (до 72%), а также клубни картофеля (до 25%). В клубнях картофеля крахмальные зерна плавают в клеточном соке, в злаках они плотно склеены белковым веществом клейковиной.
Физические свойства
Крахмал – белое аморфное вещество, без вкуса и запаха, нерастворимое в холодной воде, в горячей воде набухает и частично растворяется, образуя вязкий коллоидный раствор (крахмальный клейстер).
Крахмал существует в двух формах: амилоза – линейный полимер, растворимый в горячей воде, амилопектин – разветвлённый полимер, не растворимый в воде, лишь набухает.
Химические свойства крахмала
Химические свойства крахмала объясняются его строением.
Крахмал не дает реакцию «серебряного зеркала», однако ее дают продукты его гидролиза.
1. Гидролиз крахмала
При нагревании в кислой среде крахмал гидролизуется с разрывом связей между остатками α-глюкозы. При этом образуется ряд промежуточных продуктов, в частности мальтоза. Конечным продуктом гидролиза является глюкоза:
Процесс гидролиза протекает ступенчато, схематически его можно изобразить так:
«Кислотный гидролиз крахмала»
Реакцию превращения крахмала в глюкозу при каталитическом действии серной кислоты открыл в 1911 г. русский ученый К.Кирхгоф (реакция Кирхгофа).
2. Качественная реакция на крахмал
Так как молекула амилозы представляет собой спираль, то при взаимодействии амилозы с йодом в водном растворе молекулы йода входят во внутренний канал спирали, образуя так называемое соединение включения.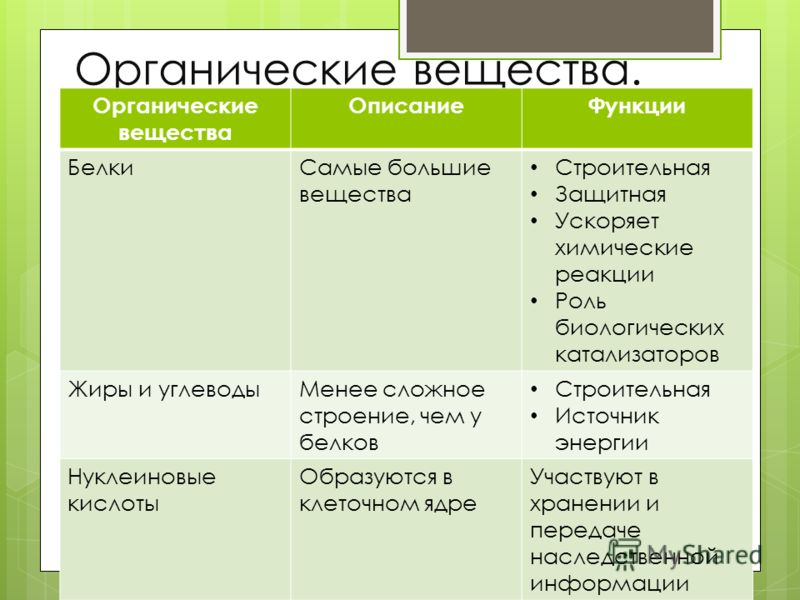
Раствор йода окрашивает крахмал в синий цвет. При нагревании окрашивание исчезает (комплекс разрушается), при охлаждении появляется вновь.
(С6Н10О5)n + I2 → I2 ⸱ (С6Н10О5)n
синее окрашивание
Углеводы — определение, структура, типы, примеры, функции
Сагар Арьял
Содержание
Что такое углеводы?
Углеводы представляют собой группу встречающихся в природе карбонильных соединений (альдегидов или кетонов), которые также содержат несколько гидроксильных групп.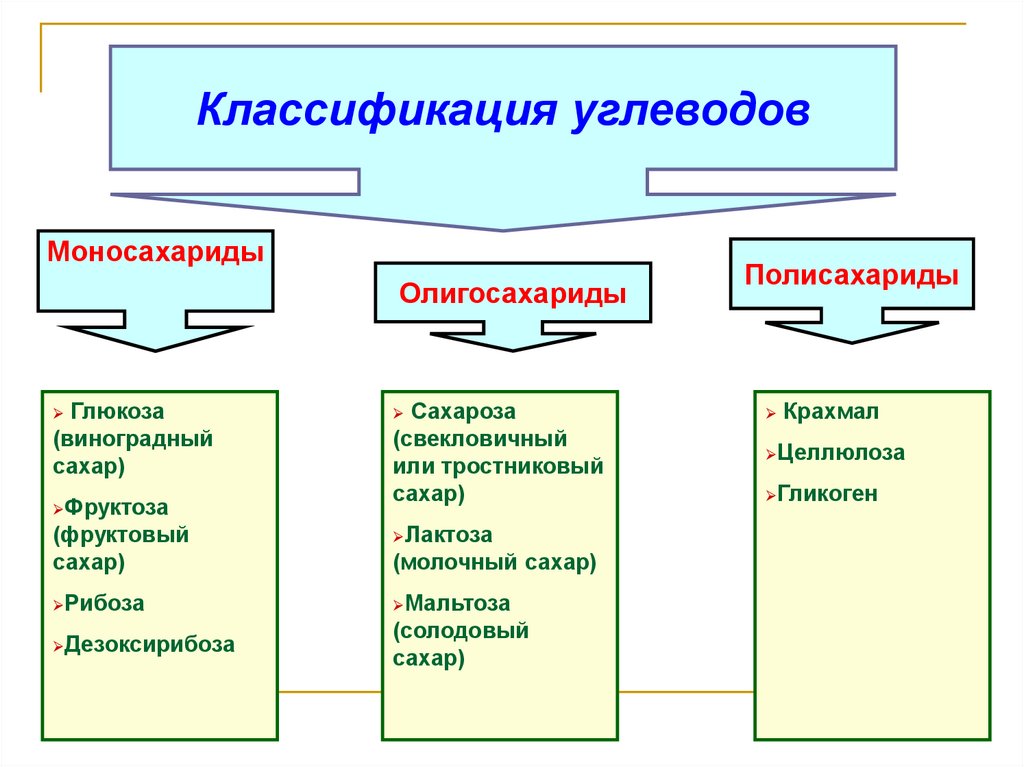 Он может также включать их производные, которые дают такие соединения при гидролизе. Это самые распространенные органические молекулы в природе, их также называют «сахариды». Углеводы, растворимые в воде и сладкие на вкус, называются «сахарами».
Он может также включать их производные, которые дают такие соединения при гидролизе. Это самые распространенные органические молекулы в природе, их также называют «сахариды». Углеводы, растворимые в воде и сладкие на вкус, называются «сахарами».
Структура углеводов
- Углеводы состоят из углерода, водорода и кислорода.
- Общая эмпирическая структура углеводов: (CH 2 O) n .
- Они представляют собой органические соединения, организованные в виде альдегидов или кетонов с несколькими гидроксильными группами, отходящими от углеродной цепи.
- Строительными элементами всех углеводов являются простые сахара, называемые моносахаридами.
- Моносахарид может быть полигидроксиальдегидом (альдозой) или полигидроксикетоном (кетозой).
Углеводы могут быть структурно представлены в любой из трех форм:
- Структура с открытой цепью.
- Структура из полуацеталя.

- Структура Хаворта.
Структура с открытой цепью – это форма углеводов с длинной прямой цепью.
Структура полуацеталя – здесь первый углерод глюкозы конденсируется с группой -ОН 5-го углерода с образованием кольцевой структуры.
Структура Haworth – Наличие кольцевой структуры пиранозы.
Свойства углеводов.
Физические свойства углеводов.
- Стереоизомерия. Пример: Глюкоза имеет два изомера относительно предпоследнего атома углерода. Это D-глюкоза и L-глюкоза.
- Оптическая активность – Это вращение плоскополяризованного света с образованием (+) глюкозы и (-) глюкозы.
- Диастереоизомеры – Конфигурационные изменения в отношении C2, C3 или C4 в глюкозе. Пример: манноза, галактоза.
- Анномеризм – это пространственная конфигурация по отношению к первому атому углерода в альдозах и второму атому углерода в кетозах.

Химические свойства углеводов
- Образование озазона : Озазоны представляют собой производные углеводов, когда сахара реагируют с избытком фенилгидразина. например. Глюкозазон
- Тест Бенедикта: Восстанавливающие сахара при нагревании в присутствии щелочи превращаются в сильнодействующие восстанавливающие соединения, известные как энедиолы. Когда раствор реагента Бенедикта и восстанавливающие сахара нагревают вместе, раствор меняет свой цвет на оранжево-красный/кирпично-красный.
- Окисление: Моносахариды являются восстанавливающими сахарами, если их карбонильные группы окисляются с образованием карбоновых кислот. В тесте Бенедикта D-глюкоза окисляется до D-глюконовой кислоты, поэтому глюкоза считается восстанавливающим сахаром.
- Восстановление до спиртов: Группы C=O в формах углеводов с открытой цепью могут быть восстановлены до спиртов боргидридом натрия, NaBH 4 или каталитическим гидрированием (h3, Ni, EtOH/h3O).
 Продукты известны как «альдиты».
Продукты известны как «альдиты».
Свойства моносахаридов
- Большинство моносахаридов имеют сладкий вкус (самая сладкая фруктоза; на 73% слаще сахарозы).
- Они являются твердыми веществами при комнатной температуре.
- Они чрезвычайно растворимы в воде: – Несмотря на их высокую молекулярную массу, наличие большого количества групп ОН делает моносахариды намного более растворимыми в воде, чем большинство молекул с аналогичной молекулярной массой.
- Глюкоза может растворяться в незначительном количестве воды для приготовления сиропа (1 г/1 мл вод. ст.).
Классификация углеводов (типы углеводов)
Простые углеводы включают отдельные сахара (моносахариды) и полимеры, олигосахариды и полисахариды.
Моносахариды
- Простейшая группа углеводов, которую часто называют простыми сахарами, поскольку они не могут подвергаться дальнейшему гидролизу.

- Бесцветные кристаллические вещества, растворимые в воде и нерастворимые в неполярных растворителях.
- Это соединения, содержащие свободную альдегидную или кетоновую группу.
- Общая формула C n (h3O) n или C n H 2n O n .
- Они классифицируются по количеству содержащихся в них атомов углерода, а также на основе присутствующей функциональной группы.
- Таким образом, моносахариды с 3, 4, 5, 6, 7… атомами углерода называются триозами, тетрозами, пентозами, гексозами, гептозами и т. д., а также альдозами или кетозами в зависимости от того, содержат ли они альдегидную или кетоновую группу.
- Примеры: Глюкоза, Фруктоза, Эритрулоза, Рибулоза.
Олигосахариды
- Олигосахариды представляют собой сложные сахара, которые при гидролизе дают от 2 до 10 молекул одного и того же или разных моносахаридов.
- Моносахаридные звенья соединены гликозидной связью.

- В зависимости от количества моносахаридных звеньев он далее классифицируется как дисахарид, трисахарид, тетрасахарид и т. д.
- Олигосахариды, дающие 2 молекулы моносахаридов при гидролизе, известны как дисахариды, а олигосахариды, дающие 3 или 4 моносахарида, известны как трисахариды и тетрасахариды соответственно и так далее.
- Общая формула дисахаридов — C n (h3O) n-1 , а трисахаридов — C n (h3O) n-2 и так далее.
- Примеры: Дисахариды включают сахарозу, лактозу, мальтозу и т. д.
- Трисахариды: Рафиноза, Рабиноза.
Полисахариды
- Их также называют «гликанами».
- Полисахариды содержат более 10 единиц моносахаридов и могут иметь длину в несколько сотен единиц сахара.
- Они дают более 10 молекул моносахаридов при гидролизе.
- Полисахариды отличаются друг от друга идентичностью повторяющихся моносахаридных звеньев, длиной их цепей, типами связывающих звеньев и степенью разветвления.

- Они в первую очередь связаны с двумя важными функциями, т.е. Структурные функции и хранение энергии.
- Далее они классифицируются в зависимости от типа молекул, образующихся в результате гидролиза.
- Они могут быть гомополисахаридами e, содержащими моносахариды одного типа, или гетерополисахаридами , т. е. моносахаридами разных типов.
- Примерами гомополисахаридов являются крахмал, гликоген, целлюлоза, пектин.
- Гетерополисахариды – гиалуроновая кислота, хондроитин.
Функции углеводов
Углеводы представляют собой широко распространенные молекулы в тканях растений и животных. У растений и членистоногих углеводы из скелетных структур, они также служат запасами пищи у растений и животных. Они являются важными источниками энергии, необходимыми для различных метаболических процессов, энергия получается в результате окисления.
Некоторые из их основных функций включают
- Живые организмы используют углеводы в качестве доступной энергии для подпитки клеточных реакций.
 Они являются наиболее распространенным диетическим источником энергии (4 ккал/грамм) для всех живых существ.
Они являются наиболее распространенным диетическим источником энергии (4 ккал/грамм) для всех живых существ. - Углеводы наряду с тем, что они являются основным источником энергии для многих животных, являются мгновенными источниками энергии. Глюкоза расщепляется гликолизом/циклом Кребса с образованием АТФ.
- Служат запасами энергии, топливом и метаболическими промежуточными продуктами. Он запасается в виде гликогена у животных и крахмала у растений.
- Накопленные углеводы служат источником энергии вместо белков.
- Образуют структурные и защитные компоненты, как и в клеточной стенке растений и микроорганизмов. Структурные элементы клеточных стенок бактерий (пептидогликан или муреин), растений (целлюлоза) и животных (хитин).
- Углеводы являются промежуточными продуктами биосинтеза жиров и белков.
- Углеводы помогают в регуляции нервной ткани и являются источником энергии для мозга.
- Углеводы связываются с липидами и белками с образованием поверхностных антигенов, рецепторных молекул, витаминов и антибиотиков.

- Формирование структурного каркаса РНК и ДНК (рибонуклеиновая кислота и дезоксирибонуклеиновая кислота).
- Они связаны со многими белками и липидами. Такие связанные углеводы важны для связи между клетками и во взаимодействиях между клетками и другими элементами клеточной среды.
- У животных они являются важным компонентом соединительной ткани.
- Углеводы, богатые клетчаткой, помогают предотвратить запоры.
- Кроме того, они помогают модулировать иммунную систему.
Ссылки
- Ленингер А.Л., Нельсон Д.Л. и Кокс М.М. (2000). Ленингеровские принципы биохимии. Нью-Йорк: издательство Worth.
- Мэдиган, М.Т., Мартинко, Дж.М., Бендер, К.С., Бакли, Д.Х., и Шталь, Д.А. (2015). Брок биология микроорганизмов (четырнадцатое издание). Бостон: Пирсон.
- Родвелл, В. В., Ботам, К. М., Кеннелли, П. Дж., Вейл, П. А., и Бендер, Д. А. (2015). Иллюстрированная биохимия Харпера (30-е изд.). Нью-Йорк, штат Нью-Йорк: McGraw-Hill Education LLC.

- https://biology.tutorvista.com/biomolecules/carbohydrates.html
Об авторе
Сагар Арьял
Сагар Арьял — микробиолог и научный блогер. Он учился в Колледже Святого Ксавьера в Майтигаре, Катманду, Непал, чтобы получить степень магистра наук в области микробиологии. С февраля 2015 г. по июнь 2019 г. он работал преподавателем в колледже Св. Ксаверия, Майтигар, Катманду, Непал.. После преподавания микробиологии более четырех лет он поступил на Центральный факультет микробиологии Трибхуванского университета, чтобы получить степень доктора философии. в сотрудничестве с Институтом фармацевтических исследований Гельмгольца Саара (HIPS), Саарбрюккен, Германия. Он интересуется исследованиями актинобактерий, миксобактерий и натуральных продуктов. Он опубликовал более 15 исследовательских статей и глав в книгах в международных журналах и известных издательствах.
Структура и функция сложных углеводов — Компьютерное моделирование
Сложные углеводы очень распространены у животных, растений и бактерий.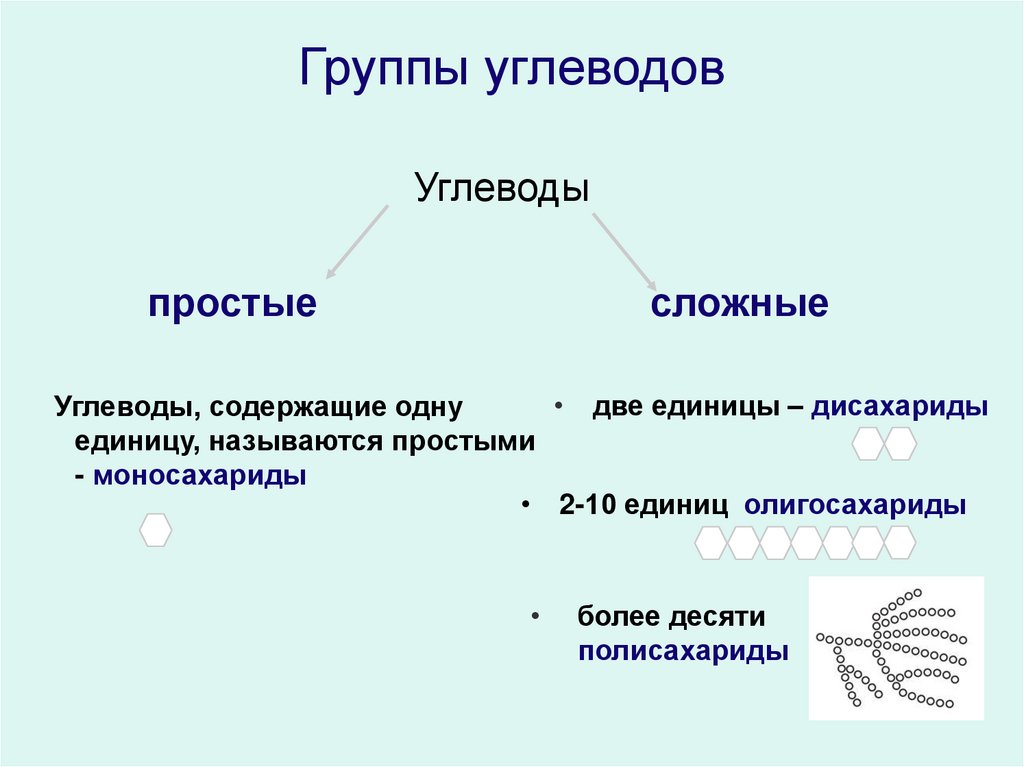 Они входят в состав клеточных мембран, а также субклеточного материала клеток. Они также обнаруживаются в физиологических жидкостях, таких как кровь, слезы, молоко и моча. Недавно было подсчитано, что определены ковалентные структуры от 4000 до 6000 природных углеводов (DOE, 1987). Многие сложные углеводы незамещены по восстанавливающим концам и называются полисахаридами; примеры включают олигосахариды молока, целлюлозу клеточных стенок растений и запасные формы, такие как крахмал и гликоген. Многие другие встречающиеся в природе сложные углеводы ковалентно связаны с другими молекулами, такими как белки или липиды, гликозидными связями остатков сахара на их восстанавливающих концах с образованием гликоконъюгатов.
Они входят в состав клеточных мембран, а также субклеточного материала клеток. Они также обнаруживаются в физиологических жидкостях, таких как кровь, слезы, молоко и моча. Недавно было подсчитано, что определены ковалентные структуры от 4000 до 6000 природных углеводов (DOE, 1987). Многие сложные углеводы незамещены по восстанавливающим концам и называются полисахаридами; примеры включают олигосахариды молока, целлюлозу клеточных стенок растений и запасные формы, такие как крахмал и гликоген. Многие другие встречающиеся в природе сложные углеводы ковалентно связаны с другими молекулами, такими как белки или липиды, гликозидными связями остатков сахара на их восстанавливающих концах с образованием гликоконъюгатов.
БИОЛОГИЧЕСКАЯ ФУНКЦИЯ
Гликопротеины выполняют множество функций в высших организмах. Коллаген является важным структурным элементом внеклеточного пространства, хрящей, костей и базальных мембран. Муцины играют важную роль в качестве смазывающих и защитных агентов в слизистых выделениях.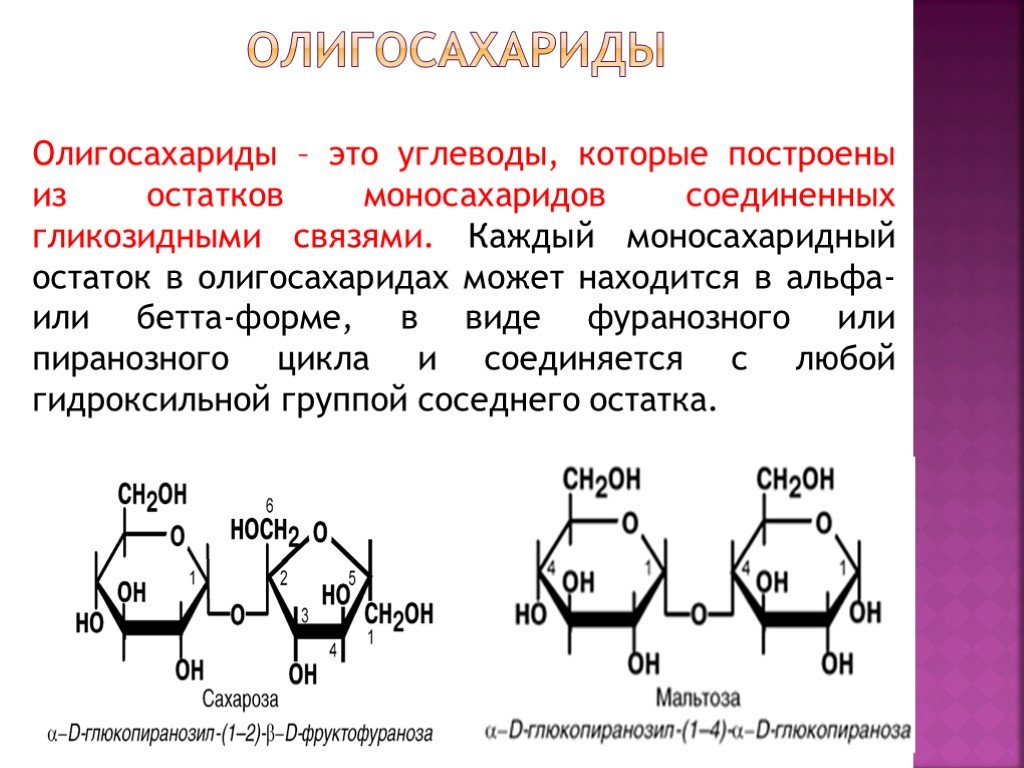 Важные иммунологические молекулы класса гликопротеинов включают иммуноглобулины, антигены гистосовместимости, антигены групп крови типов АВО и Льюиса, комплемент в механизме свертывания крови и интерферон. Многие белки плазмы человека, такие как фетуин, трансферрин и церулоплазмин, являются гликопротеинами, как и некоторые гормоны, такие как хорионический гонадотропин и тиротропин. Большинство животных и растительных лектинов представляют собой гликопротеины, как и лизосомальные ферменты. Распознавание и связывание лизосомальных ферментов со специфическими рецепторами в аппарате Гольджи и на клеточной поверхности включает один или несколько фосфорилированных остатков маннозы на N-связанных олигосахаридных цепях. Сайты узнавания на клеточной поверхности для связывания и поглощения гормонов и для взаимодействия с другими клетками, вирусами и бактериями также являются гликопротеинами.
Важные иммунологические молекулы класса гликопротеинов включают иммуноглобулины, антигены гистосовместимости, антигены групп крови типов АВО и Льюиса, комплемент в механизме свертывания крови и интерферон. Многие белки плазмы человека, такие как фетуин, трансферрин и церулоплазмин, являются гликопротеинами, как и некоторые гормоны, такие как хорионический гонадотропин и тиротропин. Большинство животных и растительных лектинов представляют собой гликопротеины, как и лизосомальные ферменты. Распознавание и связывание лизосомальных ферментов со специфическими рецепторами в аппарате Гольджи и на клеточной поверхности включает один или несколько фосфорилированных остатков маннозы на N-связанных олигосахаридных цепях. Сайты узнавания на клеточной поверхности для связывания и поглощения гормонов и для взаимодействия с другими клетками, вирусами и бактериями также являются гликопротеинами.
Многие функции гликопротеинов на клеточной поверхности также были предложены для нейтральных и кислых гликосфинголипидов. Кроме того, недавно было обнаружено, что некоторые гликосфинголипиды класса ганглиозидов ингибируют митогенный ответ факторов клеточного роста посредством аллостерической модуляции их рецепторов клеточной поверхности (Bremer et al., 1986). Онкогенная трансформация вирусной инфекцией или химическими мутагенами обычно приводит к изменениям структуры гликосфинголипидов на клеточной поверхности, так что количество некоторых типов значительно увеличивается. В некоторых случаях имеются и качественные различия из-за экспрессии генов, молчащих в дифференцированных нормальных клетках. Это особенно важно для опухолевых клеток, где опухолеассоциированные антигены могут служить основой для специфических диагностических анализов на основе моноклональных антител и, в конечном итоге, возможно, для лечения.
Кроме того, недавно было обнаружено, что некоторые гликосфинголипиды класса ганглиозидов ингибируют митогенный ответ факторов клеточного роста посредством аллостерической модуляции их рецепторов клеточной поверхности (Bremer et al., 1986). Онкогенная трансформация вирусной инфекцией или химическими мутагенами обычно приводит к изменениям структуры гликосфинголипидов на клеточной поверхности, так что количество некоторых типов значительно увеличивается. В некоторых случаях имеются и качественные различия из-за экспрессии генов, молчащих в дифференцированных нормальных клетках. Это особенно важно для опухолевых клеток, где опухолеассоциированные антигены могут служить основой для специфических диагностических анализов на основе моноклональных антител и, в конечном итоге, возможно, для лечения.
Связывание между гликозаминогликанами и другими внеклеточными макромолекулами вносит значительный вклад в структурную организацию матрикса соединительной ткани. Все гликозаминогликаны, за исключением тех, в которых отсутствуют сульфатные или карбоксильные группы, электростатически связываются с коллагеном при нейтральном pH из-за их замечательного анионного характера. Дерматансульфат, который, по-видимому, является основным гликозаминогликаном, синтезируемым клетками гладких мышц артерий, сильно связывается с липопротеинами плазмы, а гепарин также взаимодействует с некоторыми белками плазмы, включая факторы свертывания IX и XI и антитромбин III. Интересно, что стехиометрическое связывание гепарина 1:1 с остатками Lys антитромбина III, как полагают, вызывает конформационное изменение антитромбина III, которое увеличивает связывание антитромбина III с тромбином. Это связывание инактивирует тромбин. Гиалуроновая кислота осаждается на поверхности чашек Петри клетками, растущими в культуре тканей, давая им субстрат для прикрепления в процессе роста. Протеогликаны также участвуют в регуляции клеточного роста, возможно, посредством ядерных эффектов на структуру хроматина и активации ДНК-полимеразы, и могут опосредовать межклеточную коммуникацию и потерю рецепторов клеточной поверхности.
Дерматансульфат, который, по-видимому, является основным гликозаминогликаном, синтезируемым клетками гладких мышц артерий, сильно связывается с липопротеинами плазмы, а гепарин также взаимодействует с некоторыми белками плазмы, включая факторы свертывания IX и XI и антитромбин III. Интересно, что стехиометрическое связывание гепарина 1:1 с остатками Lys антитромбина III, как полагают, вызывает конформационное изменение антитромбина III, которое увеличивает связывание антитромбина III с тромбином. Это связывание инактивирует тромбин. Гиалуроновая кислота осаждается на поверхности чашек Петри клетками, растущими в культуре тканей, давая им субстрат для прикрепления в процессе роста. Протеогликаны также участвуют в регуляции клеточного роста, возможно, посредством ядерных эффектов на структуру хроматина и активации ДНК-полимеразы, и могут опосредовать межклеточную коммуникацию и потерю рецепторов клеточной поверхности.
БИОСИНТЕЗ N-СВЯЗАННЫХ ГЛИКОПРОТЕИНОВ И ГЛИКОФИНГОЛИПИДОВ
Роль углеводов в биологических функциях представляет особенно сложную проблему для будущего.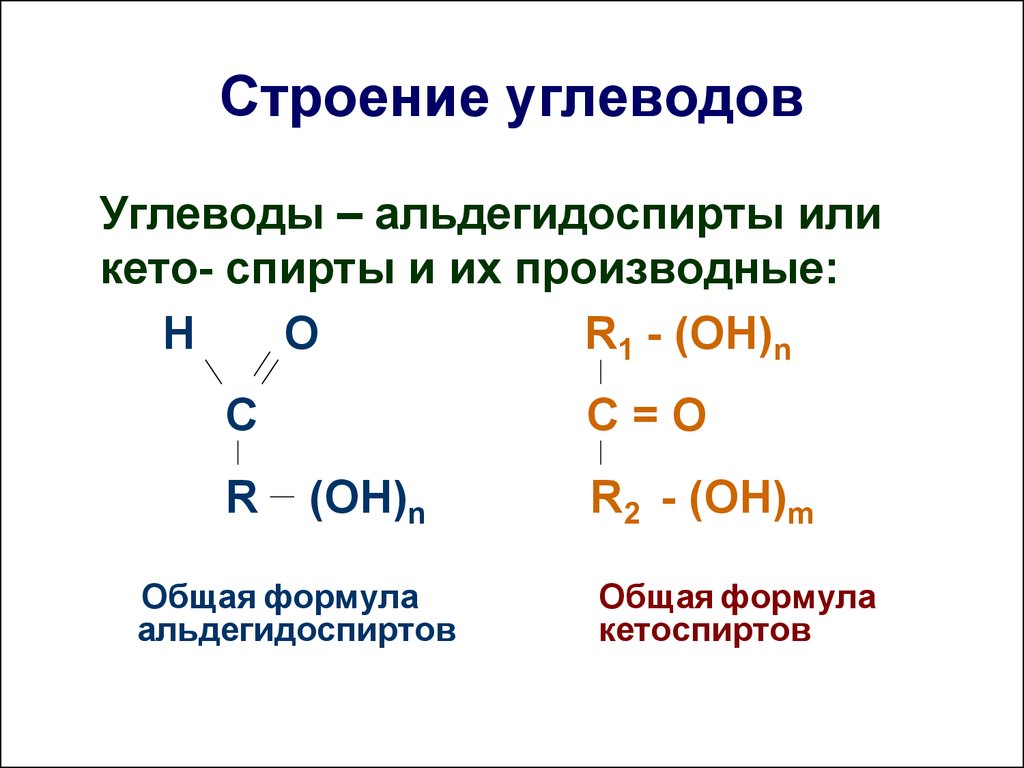 Синтез этих гликоконъюгатов происходит во время их внутриклеточного транспорта от места начальной сборки липид-связанного интермедиата (гликопротеины) или церамида (гликосфинголипиды) в эндоплазматическом ретикулуме через аппарат Гольджи на клеточную поверхность, внутриклеточные органеллы или внеклеточные Космос. Для их синтеза требуется семейство активированных доноров сахара, называемых сахарными нуклеотидами, которые синтезируются в цитозольной фракции клеток из сахарофосфатов и нуклеозидтрифосфатов. Интересным исключением является сахарный нуклеотид сиаловой кислоты, называемый цитидинмонофосфат сиаловой кислоты (CMP-NeuAc), который синтезируется в ядре из свободной сиаловой кислоты и CTP. Ферменты, участвующие в биосинтезе гликоконъюгатов, представляют собой гликозилтрансферазы, которые катализируют перенос остатков сахаров от нуклеотидов сахара к невосстанавливающему концу растущей углеводной цепи.
Синтез этих гликоконъюгатов происходит во время их внутриклеточного транспорта от места начальной сборки липид-связанного интермедиата (гликопротеины) или церамида (гликосфинголипиды) в эндоплазматическом ретикулуме через аппарат Гольджи на клеточную поверхность, внутриклеточные органеллы или внеклеточные Космос. Для их синтеза требуется семейство активированных доноров сахара, называемых сахарными нуклеотидами, которые синтезируются в цитозольной фракции клеток из сахарофосфатов и нуклеозидтрифосфатов. Интересным исключением является сахарный нуклеотид сиаловой кислоты, называемый цитидинмонофосфат сиаловой кислоты (CMP-NeuAc), который синтезируется в ядре из свободной сиаловой кислоты и CTP. Ферменты, участвующие в биосинтезе гликоконъюгатов, представляют собой гликозилтрансферазы, которые катализируют перенос остатков сахаров от нуклеотидов сахара к невосстанавливающему концу растущей углеводной цепи.
Различие между биосинтезом гликоконъюгатов и синтезом белка является ключевым; последний происходит на матрице матричной РНК и поэтому определяется генетическим кодом одного структурного гена.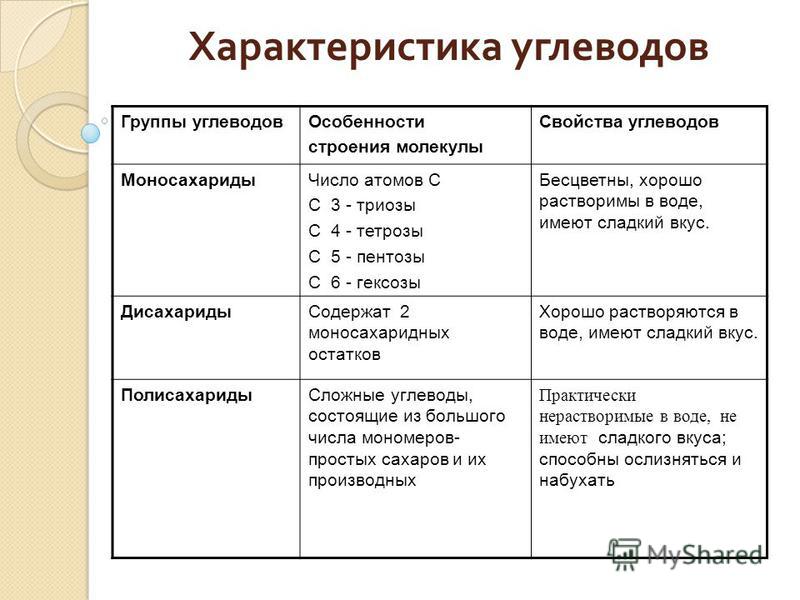 1 В противоположность этому, синтез гликоконъюгатов осуществляется путем поэтапного добавления единиц сахара с использованием разных ферментов на каждом этапе. Следовательно, ни одна последовательность ДНК не участвует в определении первичной структуры сложного углевода, поскольку порядок добавления сахаров зависит от специфичности субстрата и кинетических характеристик различных гликозилтрансфераз, каждая из которых кодируется отдельным структурным геном. . Ясно, что невозможно предсказать первичную структуру сложных углеводов по последовательностям ДНК. Следовательно, трехмерные структуры гликопротеинов, гликосфинголипидов и других сложных молекул, содержащих углеводы, невозможно полностью предсказать без экспериментального структурного анализа углеводов.
1 В противоположность этому, синтез гликоконъюгатов осуществляется путем поэтапного добавления единиц сахара с использованием разных ферментов на каждом этапе. Следовательно, ни одна последовательность ДНК не участвует в определении первичной структуры сложного углевода, поскольку порядок добавления сахаров зависит от специфичности субстрата и кинетических характеристик различных гликозилтрансфераз, каждая из которых кодируется отдельным структурным геном. . Ясно, что невозможно предсказать первичную структуру сложных углеводов по последовательностям ДНК. Следовательно, трехмерные структуры гликопротеинов, гликосфинголипидов и других сложных молекул, содержащих углеводы, невозможно полностью предсказать без экспериментального структурного анализа углеводов.
Snider (1984) сообщил, что гликопротеины N-связанного типа синтезируются как котрансляционное событие в шероховатой эндоплазматической сети. В то время как полипептидная цепь транслируется на матричной РНК и одновременно проходит через мембрану эндоплазматического ретикулума в цистернальное пространство (просвет), одиночный олигосахарид координированно синтезируется на фосфорилированном полиизопреноидном спирте (долихоле у высших животных и более мелких подобных веществах у насекомых). , дрожжи и растения). Весь олигосахарид-предшественник затем переносится на соответствующие остатки аспарагина в формирующейся полипептидной цепи (вероятно, перед укладкой в третичную структуру) в соответствии с правилами специфичности, которые до конца не поняты. Для переноса требуется последовательность Asn-X-Ser или Asn-X-Thr, но также задействованы дополнительные факторы. Доступность остатка Asn может быть одним из таких факторов, и оценка этой возможности может быть сделана с помощью методов прогнозирования, описанных в этом отчете.
, дрожжи и растения). Весь олигосахарид-предшественник затем переносится на соответствующие остатки аспарагина в формирующейся полипептидной цепи (вероятно, перед укладкой в третичную структуру) в соответствии с правилами специфичности, которые до конца не поняты. Для переноса требуется последовательность Asn-X-Ser или Asn-X-Thr, но также задействованы дополнительные факторы. Доступность остатка Asn может быть одним из таких факторов, и оценка этой возможности может быть сделана с помощью методов прогнозирования, описанных в этом отчете.
Вторая стадия синтеза N-связанного гликопротеина включает обширную посттрансляционную модификацию связанного с белком олигосахарида-предшественника путем удаления и добавления сахаров. Во многих случаях белковая часть также модифицируется частичным протеолитическим расщеплением и/или добавлением модифицирующих функцию групп к определенным аминокислотным остаткам. Посттрансляционная модификация инициируется в шероховатой эндоплазматической сети удалением трех остатков глюкозы двумя специфическими мембраносвязанными глюкозидазами.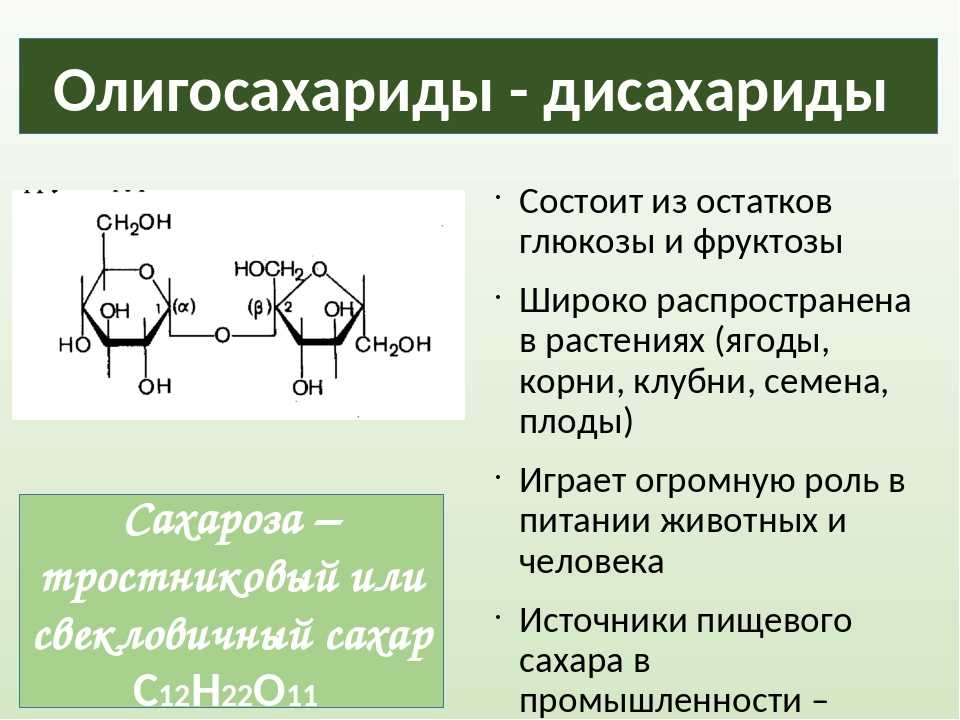 Эти остатки глюкозы, по-видимому, имеют единственную функцию обеспечения переноса олигосахаридной цепи от долихолпирофосфата к зарождающимся полипептидным цепям. Будет интересно определить по трехмерным структурам и предсказанным конформациям, как эти группы взаимодействуют с ферментом трансферазой, задействованным на этом этапе. Цепи зрелых олигосахаридов с высоким содержанием маннозы синтезируют путем последующего удаления до четырех остатков маннозила из трех ветвей структуры предшественника. В этом процессе участвуют по крайней мере три различных альфа-маннозидазы в аппарате Гольджи. Эти ферменты и две глюкозидазы являются гидролазами, как и лизосомальные гликозидазы, но их активность максимальна при нейтральном рН, в отличие от лизосомальных ферментов, которые проявляют наибольшую каталитическую активность при кислом рН.
Эти остатки глюкозы, по-видимому, имеют единственную функцию обеспечения переноса олигосахаридной цепи от долихолпирофосфата к зарождающимся полипептидным цепям. Будет интересно определить по трехмерным структурам и предсказанным конформациям, как эти группы взаимодействуют с ферментом трансферазой, задействованным на этом этапе. Цепи зрелых олигосахаридов с высоким содержанием маннозы синтезируют путем последующего удаления до четырех остатков маннозила из трех ветвей структуры предшественника. В этом процессе участвуют по крайней мере три различных альфа-маннозидазы в аппарате Гольджи. Эти ферменты и две глюкозидазы являются гидролазами, как и лизосомальные гликозидазы, но их активность максимальна при нейтральном рН, в отличие от лизосомальных ферментов, которые проявляют наибольшую каталитическую активность при кислом рН.
В эукариотических клетках олигосахарид с высоким содержанием маннозы с пятью единицами маннозы (см. ) является прямым предшественником сложных и гибридных структур.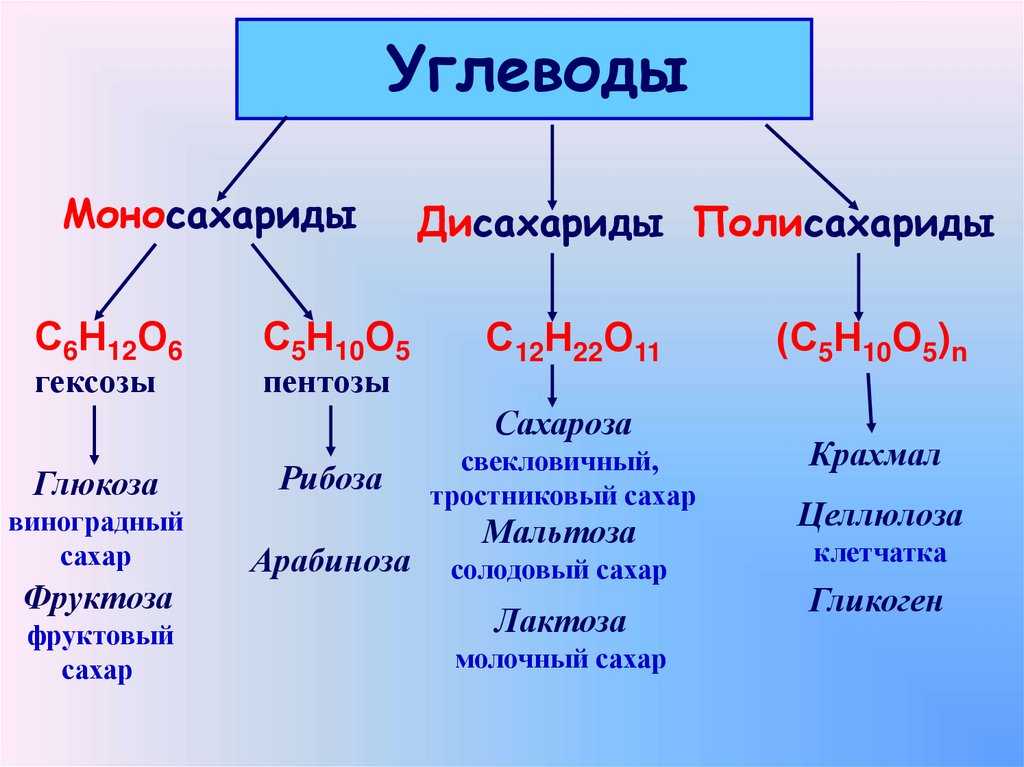 Начальным этапом в аппарате Гольджи является добавление остатка N-ацетилглюкозамина к последнему оставшемуся человеку на ветви I (*), после чего оставшиеся два остатка человека на ветвях II и III могут быть удалены альфа-маннозидазами, которые почти определенно отличается от тех, кто участвовал в предыдущих шагах. На этом этапе могут быть сделаны дополнительные разветвления для получения три- и тетраантеннальных структур, а заключительные стадии процессинга осуществляются путем добавления остатков галактозы, N-ацетилглюкозамина, сиаловой кислоты и фукозы для получения зрелых, сложных, N-связанных цепи. Интересная N-ацетилглюкозаминилтрансфераза может добавлять бета-1,4-связанный остаток GlcNAc к разветвленному бета-связанному остатку маннозы внутренней области ядра (0), чтобы получить «разделенную пополам структуру». Этот этап был предметом интенсивного изучения Карвером и его коллегами, которые интересовались структурной специфичностью фермента с различными конформациями предшественников олигосахаридов (Карвер и Бриссон, 19).
Начальным этапом в аппарате Гольджи является добавление остатка N-ацетилглюкозамина к последнему оставшемуся человеку на ветви I (*), после чего оставшиеся два остатка человека на ветвях II и III могут быть удалены альфа-маннозидазами, которые почти определенно отличается от тех, кто участвовал в предыдущих шагах. На этом этапе могут быть сделаны дополнительные разветвления для получения три- и тетраантеннальных структур, а заключительные стадии процессинга осуществляются путем добавления остатков галактозы, N-ацетилглюкозамина, сиаловой кислоты и фукозы для получения зрелых, сложных, N-связанных цепи. Интересная N-ацетилглюкозаминилтрансфераза может добавлять бета-1,4-связанный остаток GlcNAc к разветвленному бета-связанному остатку маннозы внутренней области ядра (0), чтобы получить «разделенную пополам структуру». Этот этап был предметом интенсивного изучения Карвером и его коллегами, которые интересовались структурной специфичностью фермента с различными конформациями предшественников олигосахаридов (Карвер и Бриссон, 19).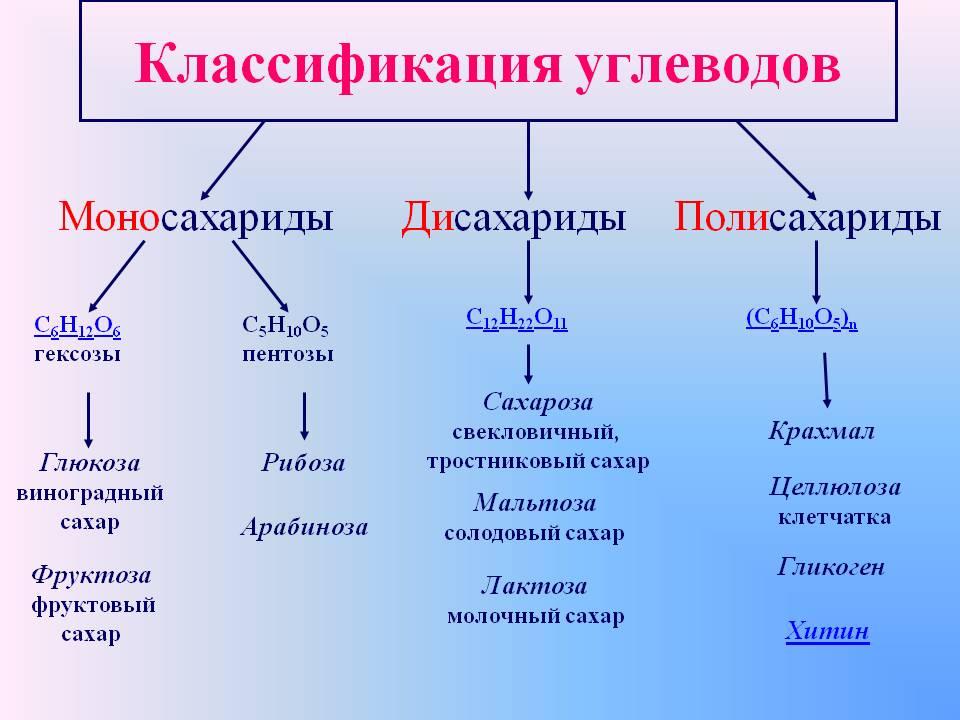 84).
84).
РИСУНОК 8-1
Промежуточный продукт, частично процессированный аспарагином — связанная углеводная цепь гликопротеина.
Вполне вероятно, что в исследованиях путей процессинга и степени процессинга цепей олигосахаридов будут использоваться методы прогнозирования. Если контроль возникает из-за специфичности фермента в отношении конкретной трехмерной структуры субстрата, может оказаться возможным определить эти предпочтения и, исходя из предсказаний распределения трехмерных структур олигосахарида, присоединенного к гликопротеиновому субстрату, предсказать, насколько далеко углеводная цепь будет обработана.
Лизосомальные ферменты содержат одну или несколько фосфатных групп на маннозных остатках олигосахаридных цепей с высоким содержанием маннозы. Маннозо-6-фосфатные группы являются специфическими маркерами распознавания, которые участвуют в транспорте лизосомальных ферментов из аппарата Гольджи или из клеток в лизосомы. В плазматической мембране были обнаружены два мембраносвязанных маннозо-6-фосфатных рецептора; по крайней мере, один из них также находится в мембранах Гольджи.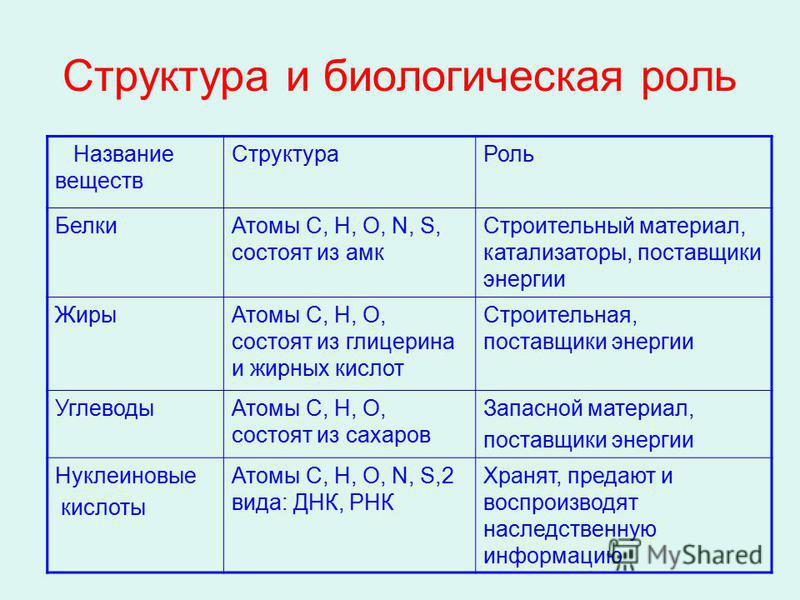 Хотя специфичность их связывания исследована довольно подробно, другие аспекты не определены: природа взаимодействия фосфорилированных остатков маннозы с рецепторами и трехмерные структуры лизосомальных фермент-рецепторных комплексов.
Хотя специфичность их связывания исследована довольно подробно, другие аспекты не определены: природа взаимодействия фосфорилированных остатков маннозы с рецепторами и трехмерные структуры лизосомальных фермент-рецепторных комплексов.
Другой интересный аспект синтеза лизосомальных ферментов включает определение структурных доменов на свернутых белках, распознаваемых ферментом, который инициирует фосфорилирование остатков маннозы, который представляет собой N-ацетилглюкозамин-фосфотрансферазу (GlcNAc-P трансферазу) в аппарате Гольджи. Это механизм, с помощью которого для фосфорилирования отбираются только белки лизосомальных ферментов. Это особенно важно, поскольку одна из форм генетического лизосомного нарушения накопления, называемая муколипидозом II, возникает в результате дефекта связывающего домена GlcNAc-P трансферазы для лизосомальных ферментных белков. Возможно, эту проблему можно решить только с помощью компьютерного моделирования, позволяющего предсказать трехмерные структуры обоих белков.
Гликосфинголипиды синтезируют аналогичным образом, за исключением того, что церамид выполняет функцию долихола для гликопротеинов, а перенос происходит непосредственно от сахарного нуклеотида к акцепторному гликолипиду. Церамид является акцептором либо глюкозы (из UDP-Glc), либо галактозы (из UDP-Gal), образуя глюкозилцерамид или галактозилцерамид. Эти простые гликосфинголипиды преобладают в плазме и головном мозге человека соответственно, а также служат предшественниками более сложных гликосфинголипидов. В большинстве органов, включая головной мозг, основные пути включают превращение глюкозилцерамида в лактозилцерамид, Gal-бета-1,4-Glc-Cer. Лактозилцерамид является субстратом ряда гликозилтрансфераз, продукты которых являются первыми интермедиатами в синтезе родственных гликосфинголипидов, которые можно классифицировать по их общим структурным характеристикам. Уже охарактеризовано более 100 различных гликосфинголипидов, и все еще открываются новые соединения. Хотя некоторые из гликосфинголипидов могут содержать от 15 до 35 или более остатков сахара, большинство широко встречающихся типов имеют от 4 до 10 остатков в олигосахаридной цепи.
АНАЛИЗ ПЕРВИЧНОЙ И ТРЕТИЧНОЙ СТРУКТУРЫ
Полное понимание взаимодействий между углеводами и белками (ферментами, лектинами, антителами и рецепторами клеточной поверхности) будет зависеть от определения точных трехмерных структур обоих типов молекул. Как было отмечено, первичные структуры олигосахаридных цепей сложных углеводов не могут быть выведены из последовательностей ДНК и поэтому должны быть определены химическим и спектроскопическим анализом. Современные хроматографические методы разделения, наряду с масс-спектрометрией и ядерным магнитным резонансом (ЯМР), позволяют проводить полный анализ первичной структуры на образце в один микромоль. Еще предстоит определить состав; размещение остатков сахара; размер кольца; положения гликозидных связей и их аномерность; и расположение и химическая природа неуглеводных заместителей, таких как липиды, сульфатные и фосфатные группы.
Трехмерные структуры углеводов представляют пространственное расположение отдельных остатков сахара.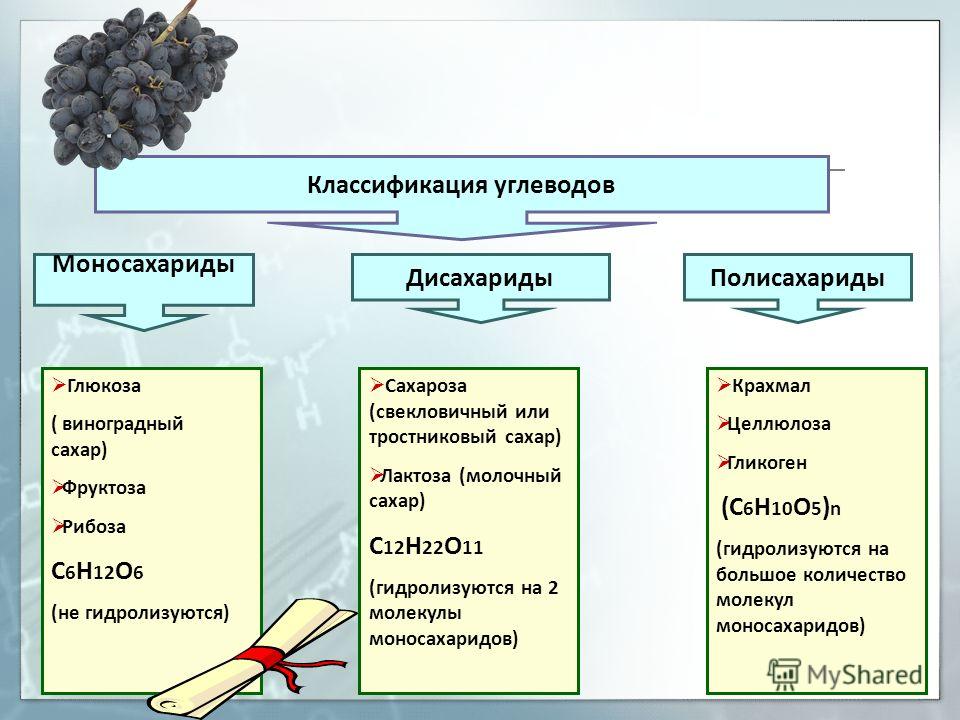 Наиболее часто встречающиеся сложные углеводы млекопитающих состоят из остатков сахаров, которые существуют в форме пиранозного кольца, наиболее стабильной и жесткой конформацией которого являются формы стула. Когда два остатка сахара ковалентно соединены гликозидной связью, они могут свободно вращаться вокруг гликозидного атома кислорода между двумя кольцами, и поэтому полученный дисахарид может принимать ряд различных конформаций, соответствующих вращениям вокруг этих двух связей. Двугранные углы при гликозидной связи (см. ) принято обозначать греческими символами phi (ϕ) и psi (ψ), где исходной конформацией (ϕ = 0°, ψ = 0°) является тот конформер, в котором C-l Связь -H-1 затмевает O-C’-X’, а связь C-1-O затмевает C’-X’-H-X’.
Наиболее часто встречающиеся сложные углеводы млекопитающих состоят из остатков сахаров, которые существуют в форме пиранозного кольца, наиболее стабильной и жесткой конформацией которого являются формы стула. Когда два остатка сахара ковалентно соединены гликозидной связью, они могут свободно вращаться вокруг гликозидного атома кислорода между двумя кольцами, и поэтому полученный дисахарид может принимать ряд различных конформаций, соответствующих вращениям вокруг этих двух связей. Двугранные углы при гликозидной связи (см. ) принято обозначать греческими символами phi (ϕ) и psi (ψ), где исходной конформацией (ϕ = 0°, ψ = 0°) является тот конформер, в котором C-l Связь -H-1 затмевает O-C’-X’, а связь C-1-O затмевает C’-X’-H-X’.
РИСУНОК 8-2
Двугранные углы, определяющие пространственное отношение двух остатков сахара в дисахариде.
Относительная ориентация соседних сахарных остатков в олигосахаридной цепи описывается указанием углов вращения (ϕ, ψ) у каждого гликозидного атома кислорода. Когда эти углы одинаковы для каждой связи, цепь имеет спиральную конформацию с n остатками на виток и h единицами перемещения вдоль оси спирали. Если n и h доступны из рентгеновских данных, то можно вычислить ϕ и ψ и наоборот. Если ϕ и ψ различны среди гликозидных связей в олигосахаридной цепи, трехмерная структура становится непериодической и, при крайних вариациях, принимает конформацию случайного клубка. Информация о возмущениях может быть получена с помощью измерений светорассеяния, вязкости, седиментации и диффузии.
Когда эти углы одинаковы для каждой связи, цепь имеет спиральную конформацию с n остатками на виток и h единицами перемещения вдоль оси спирали. Если n и h доступны из рентгеновских данных, то можно вычислить ϕ и ψ и наоборот. Если ϕ и ψ различны среди гликозидных связей в олигосахаридной цепи, трехмерная структура становится непериодической и, при крайних вариациях, принимает конформацию случайного клубка. Информация о возмущениях может быть получена с помощью измерений светорассеяния, вязкости, седиментации и диффузии.
РЕНТГЕНОВСКИЙ АНАЛИЗ КРИСТАЛЛИЧЕСКИХ СТРУКТУР УГЛЕВОДОВ
Из трех основных классов сложных биологических молекул у нас есть наименьшая структурная информация об углеводах с атомным разрешением. Это связано с тем, что они не были кристаллизованы, и, следовательно, нет соответствующей базы данных о кристаллической структуре, кроме базы данных от простых мономеров до тримеров, на основе которой можно было бы моделировать классические или полуэмпирические квантово-механические расчеты. Типичными примерами являются олигосахариды, специфичные для группы крови, кордовые факторы и липиды A и X. Исключением являются циклодекстрины, которые хорошо кристаллизуются, но конформационно относятся к отдельному классу. Структуры, полученные из структуры волокон полисахаридов, зависят от модели и не являются источником окончательных структурных данных. Стахиоза, олигосахарид, состоящий из четырех сахарных остатков, является крупнейшим нециклическим олигосахаридом, для которого проводится анализ кристаллической структуры, но даже в этом случае связанная с ним структура воды не определена.
Типичными примерами являются олигосахариды, специфичные для группы крови, кордовые факторы и липиды A и X. Исключением являются циклодекстрины, которые хорошо кристаллизуются, но конформационно относятся к отдельному классу. Структуры, полученные из структуры волокон полисахаридов, зависят от модели и не являются источником окончательных структурных данных. Стахиоза, олигосахарид, состоящий из четырех сахарных остатков, является крупнейшим нециклическим олигосахаридом, для которого проводится анализ кристаллической структуры, но даже в этом случае связанная с ним структура воды не определена.
Проблема кристалличности присуща только частично. Углеводы сольватируются иначе, чем белки, олигонуклеотиды или нуклеиновые кислоты. Однако было предпринято меньше усилий для получения значительных количеств конфигурационно-однородного материала , необходимого для проведения экспериментов по кристаллизации, чем для белков и нуклеиновых кислот. Другим аспектом кристаллографии гликоконъюгатов является то, что электронная плотность для олигосахаридной части гликопротеинов редко интерпретируется, даже несмотря на то, что было изучено несколько кристаллических гликопротеинов. Это связано с тем, что стандартные программы уточнения не могут работать с олигосахаридами или в месте гликозилирования присутствует микрогетерогенность, поэтому он не учитывается в модели. Таким образом, потенциально ценный источник информации не используется из-за отсутствия надлежащей разработки программ или стратегических подходов к решению проблемы микрогетерогенности.
Это связано с тем, что стандартные программы уточнения не могут работать с олигосахаридами или в месте гликозилирования присутствует микрогетерогенность, поэтому он не учитывается в модели. Таким образом, потенциально ценный источник информации не используется из-за отсутствия надлежащей разработки программ или стратегических подходов к решению проблемы микрогетерогенности.
Стерические соображения о минимальных расстояниях сближения между атомами, полученные из наблюдаемых несвязанных расстояний в различных кристаллических структурах, могут быть использованы для предсказания допустимых конформаций. Этот подход «твердой сферы», первоначально разработанный В.С.Р. Рао в середине 1970-х годов, представляет собой рудиментарный метод теоретических расчетов, который игнорирует электростатические эффекты (водородные связи), но дает качественное предсказание структуры. Впоследствии этот подход был расширен за счет адаптации расчетов энергии, первоначально использовавшихся для пептидов, где потенциальная энергия делится на функции, описывающие дискретные вклады, такие как энергии Ван-дер-Ваальса, электростатические взаимодействия, энергия кручения, энергия водородных связей, деформации связей и углов (Бок , 1983).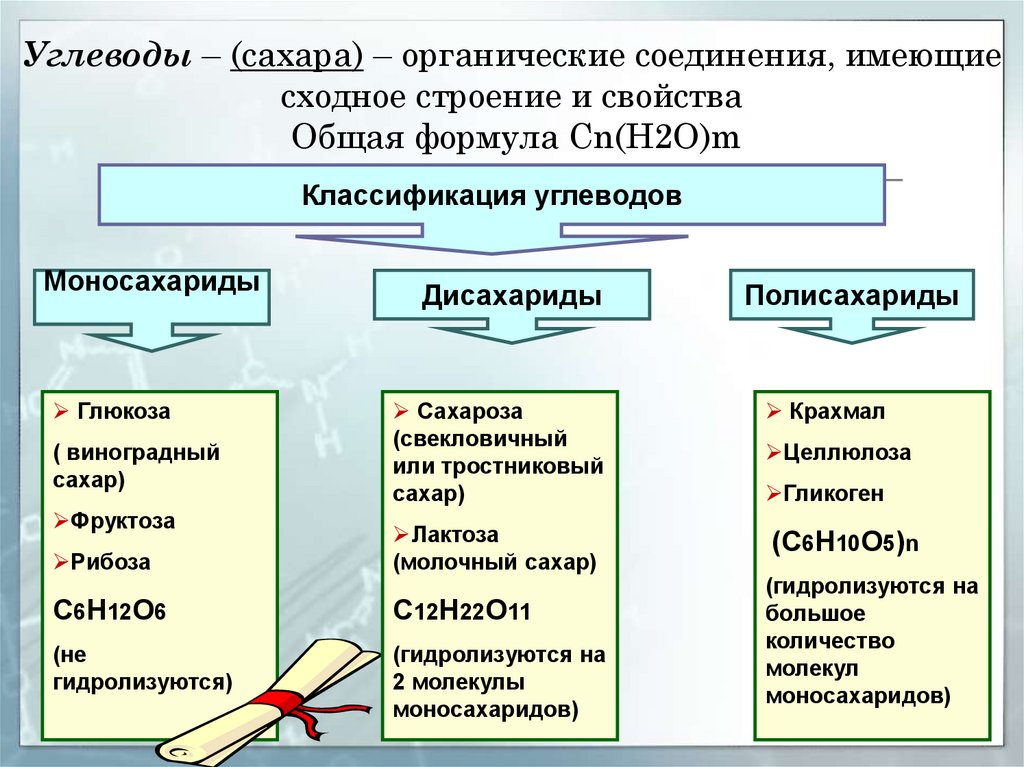 Данные представлены в виде компьютерных карт энергетических контуров.
Данные представлены в виде компьютерных карт энергетических контуров.
В большей части недавней литературы расчеты конформационной энергии проводились с использованием формы параметров Рао с добавленным торсионным потенциалом относительно одной из гликозидных связей (экзоаномерный эффект). Этот подход, получивший название HSEA (экзоаномерный метод твердых сфер) (Bock, 1983), с успехом использовался Лемье и Боком (1983), Карвером и Бриссоном (1984) и другими, хотя он содержит ряд непроверенных предположений. Добавление потенциала водородной связи (метод HEAH) дает результаты минимизации энергии, которые отличаются от результатов, рассчитанных методом HSEA, из которых можно получить геометрию, отличающуюся от геометрии, полученной методом HSEA.
ЯМР СТРУКТУРЫ РАСТВОРОВ УГЛЕВОДОВ
Методы протонного ЯМР предоставляют подробные экспериментальные данные, на основании которых можно определить трехмерные структуры и сравнить их с конформациями, полученными расчетами потенциальной энергии. Карвер и Камминг (1987) создали контурные карты рассчитанных NOE различных олигосахаридов с высоким содержанием маннозы в зависимости от торсионных углов φ и ψ. Затем они связали их с экспериментальными результатами, а также с конформациями минимальной энергии, оцененными с помощью различных расчетов потенциальной энергии (Карвер и Камминг, в печати). Бриссон и Карвер (1983) оценил полезность этого подхода с использованием двух гликопептидов биантеннарного сложного типа (см. ). Поскольку конформации, полученные с помощью NOE, находились в диапазоне, центрированном на конформациях с минимальной энергией, полученных из расчетов потенциальной энергии, был сделан вывод, «что усреднение движения ограничено узким диапазоном около одной стабильной конформации» (Brisson and Carver, 1983). Однако теперь оказывается, что бессмысленно искать единственную конформацию, полученную из NOE, которая удовлетворяет одному минимуму потенциальной энергии, потому что фактически молекулы могут занимать такие минимумы в течение очень небольшой части времени в растворе.
Карвер и Камминг (1987) создали контурные карты рассчитанных NOE различных олигосахаридов с высоким содержанием маннозы в зависимости от торсионных углов φ и ψ. Затем они связали их с экспериментальными результатами, а также с конформациями минимальной энергии, оцененными с помощью различных расчетов потенциальной энергии (Карвер и Камминг, в печати). Бриссон и Карвер (1983) оценил полезность этого подхода с использованием двух гликопептидов биантеннарного сложного типа (см. ). Поскольку конформации, полученные с помощью NOE, находились в диапазоне, центрированном на конформациях с минимальной энергией, полученных из расчетов потенциальной энергии, был сделан вывод, «что усреднение движения ограничено узким диапазоном около одной стабильной конформации» (Brisson and Carver, 1983). Однако теперь оказывается, что бессмысленно искать единственную конформацию, полученную из NOE, которая удовлетворяет одному минимуму потенциальной энергии, потому что фактически молекулы могут занимать такие минимумы в течение очень небольшой части времени в растворе. «Конформационная гибкость должна быть включена в теоретическую трактовку» (Карвер и Камминг, 19).87), и расчет энергетических поверхностей становится чрезвычайно важным. Последние исследования Камминга и Карвера показывают, что трехмерные структуры, определяемые NOE, могут значительно отличаться от любой конформации с минимальной энергией. Из этого они пришли к выводу, что конформации, полученные из NOE, в таких случаях могут соответствовать «виртуальным» конформациям, как определено Jardetzky (1980), как вычисленные структуры, которые на самом деле принимают лишь немногие молекулы в растворе, если вообще какие-либо.
«Конформационная гибкость должна быть включена в теоретическую трактовку» (Карвер и Камминг, 19).87), и расчет энергетических поверхностей становится чрезвычайно важным. Последние исследования Камминга и Карвера показывают, что трехмерные структуры, определяемые NOE, могут значительно отличаться от любой конформации с минимальной энергией. Из этого они пришли к выводу, что конформации, полученные из NOE, в таких случаях могут соответствовать «виртуальным» конформациям, как определено Jardetzky (1980), как вычисленные структуры, которые на самом деле принимают лишь немногие молекулы в растворе, если вообще какие-либо.
РИСУНОК 8-3
Структуры двух частично процессированных аспарагиновых связанных углеводных цепей. Разделение пополам β1,4GlcNAc B вызывает конформационное отличие от A.
Scarsdale et al. (в печати) использовали программу, основанную на молекулярной механике, в попытке смоделировать конформационное усреднение данных ЯМР. Конформации рассчитывали с использованием комбинации молекулярных потенциалов и данных ЯМР для олигосахаридной части эритроцитарного гликолипида, состоящего из трех нейтральных сахаров и аминосахара. Конформер с наименьшей энергией очень напоминал структуру, предложенную ранее. Однако соответствие данным можно улучшить, если рассмотреть два уравновешивающих конформера. Таким образом, можно определить конформации растворов сложных углеводов даже в нежестких случаях, используя комбинацию расчетов и ограничений, налагаемых экспериментальными данными ЯМР.
Конформер с наименьшей энергией очень напоминал структуру, предложенную ранее. Однако соответствие данным можно улучшить, если рассмотреть два уравновешивающих конформера. Таким образом, можно определить конформации растворов сложных углеводов даже в нежестких случаях, используя комбинацию расчетов и ограничений, налагаемых экспериментальными данными ЯМР.
Несмотря на поднятые вопросы об интерпретации результатов ЯМР и ценности потенциальной минимизации энергии, была собрана некоторая важная информация о взаимодействиях углеводных антигенов с антителами (Lemieux et al., 1985), олигосахаридов с лектинами, такими как конканавалин А ( Sekharudu et al., 1986), и олигосахариды с ферментами гликозилтрансферазами (Carver and Cumming, 1987). Дальнейшие уточнения будут зависеть от разработки согласованного набора функций потенциальной энергии, которые можно использовать с экспериментально определенными трехмерными структурами, полученными из NOE, для оценки того, распределяется ли данная молекула между несколькими низкоэнергетическими конформациями или занимает конкретную форму.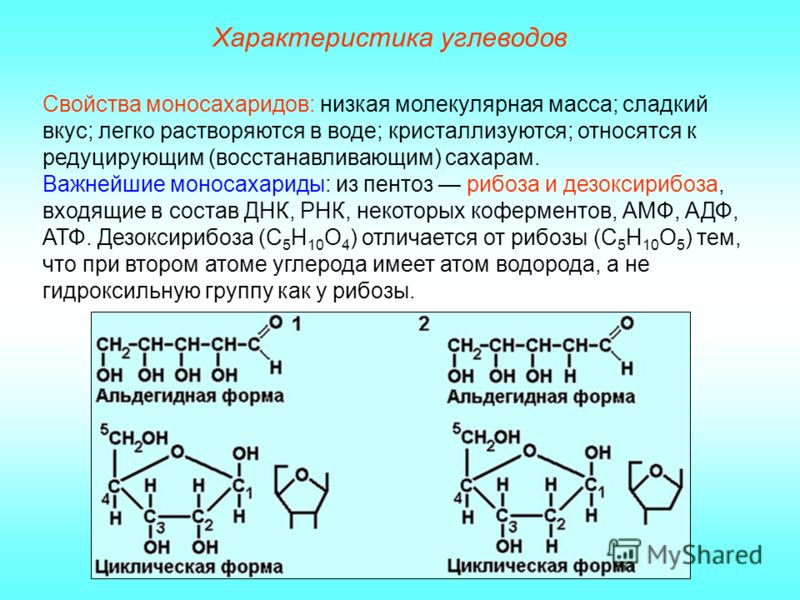 их подмножество. Твароска и Перес (1986) недавно сравнили несколько расчетов конформационной энергии и предложили общую стратегию для олигосахаридов.
их подмножество. Твароска и Перес (1986) недавно сравнили несколько расчетов конформационной энергии и предложили общую стратегию для олигосахаридов.
Компьютерное время и доступ к соответствующим процессорам массива параллельной обработки являются важными соображениями при определении уровня поддержки исследований в этой области в настоящее время. Доступность машин для очень быстрого расчета межатомных расстояний и вкладов Ван-дер-Ваальса — это вопрос, который должны решать финансирующие агентства. Интересно, что несколько суперкомпьютеров, работающих в настоящее время в кампусах, не используются на полную мощность; возможно, усилия соответствующих консультативных групп в этих центрах должны быть направлены на разработку необходимого программного обеспечения для этих компьютеров и установление политики, которая будет направлять часть их времени на компьютерное моделирование трехмерных структур.
НАДМОЛЕКУЛЯРНАЯ СТРУКТУРА
Структуры, состоящие из более чем одной макромолекулы, взаимодействуют как единое целое в биологических явлениях, таких как катализ многими ферментами, связывание на клеточной поверхности, передача сигнала через клеточные мембраны и другие биологические явления.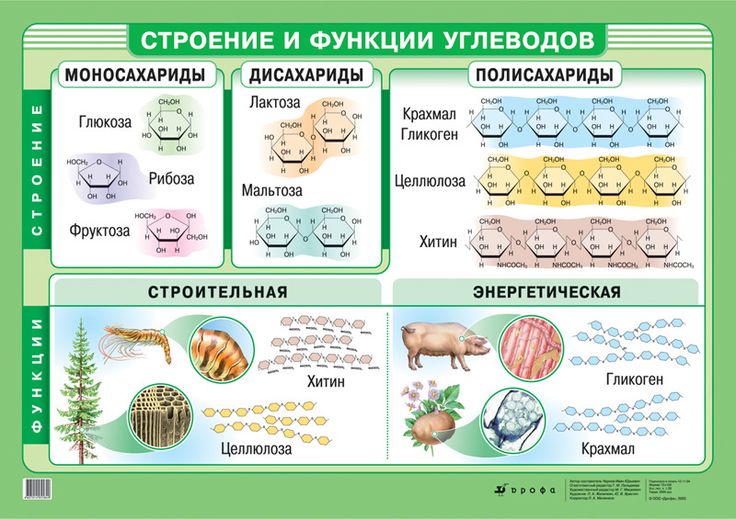 Любой фермент, состоящий более чем из одной субъединицы, следует рассматривать как надмолекулярную структуру. Когда задействовано большое количество субъединиц и, возможно, они выполняют более одной функции, может потребоваться особое внимание к их относительной пространственной ориентации. Примерами являются репликация ДНК с помощью ДНК-полимераз, когда для инициации репликации требуются комплексы, содержащие 10 или 12 белков (называемые примосомами). Рибосомы еще более сложны: для трансляции матричной РНК требуется не менее 75 белков. Поверхности, состоящие более чем из одной макромолекулы, часто ведут себя как функциональная единица. Например, поглощение холестерина многими клетками требует взаимодействия специфического рецептора клеточной поверхности с полипептидной поверхностью сложной надмолекулярной структуры, называемой липопротеином низкой плотности (ЛПНП), который состоит из белка, холестерина, фосфолипидов и триацилглицеролов. Изменение белка ЛПНП путем ацетилирования остатка Lys блокирует связывание ЛПНП с его рецептором и поглощение холестерина клеткой.
Любой фермент, состоящий более чем из одной субъединицы, следует рассматривать как надмолекулярную структуру. Когда задействовано большое количество субъединиц и, возможно, они выполняют более одной функции, может потребоваться особое внимание к их относительной пространственной ориентации. Примерами являются репликация ДНК с помощью ДНК-полимераз, когда для инициации репликации требуются комплексы, содержащие 10 или 12 белков (называемые примосомами). Рибосомы еще более сложны: для трансляции матричной РНК требуется не менее 75 белков. Поверхности, состоящие более чем из одной макромолекулы, часто ведут себя как функциональная единица. Например, поглощение холестерина многими клетками требует взаимодействия специфического рецептора клеточной поверхности с полипептидной поверхностью сложной надмолекулярной структуры, называемой липопротеином низкой плотности (ЛПНП), который состоит из белка, холестерина, фосфолипидов и триацилглицеролов. Изменение белка ЛПНП путем ацетилирования остатка Lys блокирует связывание ЛПНП с его рецептором и поглощение холестерина клеткой. Некоторые гормоны, в том числе норадреналин и эпидермальный фактор роста (EGF), а также другие сигналы, такие как свет (с родопсином), вызывают фосфорилирование белка. EGF стимулирует рост нормальных фибробластов путем связывания со специфическим трансмембранным белковым рецептором на поверхности клетки. Гормональный сигнал в этом случае передается путем самофосфорилирования рецептора на внутриклеточной стороне после связывания гормона с последующим катализируемым другими киназами фосфорилированием белков, интернализацией комплекса EGF-EGF рецептор и сложным набором последствий. в ядре и в других местах при подготовке к клеточному делению. Бремер и др. (1986) недавно обнаружили, что ганглиозид GM3 ингибирует этот процесс аллостерическим образом, предотвращая самофосфорилирование рецептора EGF после связывания EGF. Для этого GM3 во внешней половине клеточной мембраны должен взаимодействовать с доменом полипептидной цепи рецептора EGF, вероятно, вызывая конформационные изменения, препятствующие фосфорилированию.
Некоторые гормоны, в том числе норадреналин и эпидермальный фактор роста (EGF), а также другие сигналы, такие как свет (с родопсином), вызывают фосфорилирование белка. EGF стимулирует рост нормальных фибробластов путем связывания со специфическим трансмембранным белковым рецептором на поверхности клетки. Гормональный сигнал в этом случае передается путем самофосфорилирования рецептора на внутриклеточной стороне после связывания гормона с последующим катализируемым другими киназами фосфорилированием белков, интернализацией комплекса EGF-EGF рецептор и сложным набором последствий. в ядре и в других местах при подготовке к клеточному делению. Бремер и др. (1986) недавно обнаружили, что ганглиозид GM3 ингибирует этот процесс аллостерическим образом, предотвращая самофосфорилирование рецептора EGF после связывания EGF. Для этого GM3 во внешней половине клеточной мембраны должен взаимодействовать с доменом полипептидной цепи рецептора EGF, вероятно, вызывая конформационные изменения, препятствующие фосфорилированию.



 Продукты известны как «альдиты».
Продукты известны как «альдиты».


 Они являются наиболее распространенным диетическим источником энергии (4 ккал/грамм) для всех живых существ.
Они являются наиболее распространенным диетическим источником энергии (4 ккал/грамм) для всех живых существ.