Содержание
§ 4. Свойства и функции белков
Многообразие и свойства белков. По форме молекул белки можно разделить на две группы. Молекулы глобулярных белков имеют округлую форму, фибриллярные белки характеризуются вытянутой, нитевидной формой молекул. Так, глобулярными белками являются глобулины и альбумины крови, фибриноген, гемоглобин. Фибриллярные белки — кератин, коллаген, миозин, эластин и др. (рис. 9).
Белки — преимущественно водорастворимые вещества, именно в водных растворах они проявляют свою функциональную активность. Белковые молекулы несут большой поверхностный заряд. Это сказывается на каталитической активности белков, на проницаемости биологических мембран (белки входят в их состав) и других функциях. Еще одной важной особенностью белков является то, что они проявляют свою активность лишь в узких температурных рамках и в определенном диапазоне кислотности среды.
Денатурация и ренатурация белков. Одно из основных свойств белков — способность изменять структуру и свойства под влиянием различных факторов (высокая температура, действие концентрированных кислот и щелочей, тяжелых металлов и др. ). Процесс нарушения природной структуры белков под влиянием каких-либо факторов без разрушения первичной структуры называется денатурацией (от лат. де — приставка, означающая утрату, натура — природные свойства). Денатурация происходит вследствие разрыва водородных, ионных, дисульфидных и других связей, стабилизирующих пространственную структуру белковых молекул. При этом может утрачиваться их четвертичная, третичная и даже вторичная структура (рис. 10). Денатурация сопровождается потерей биологической активности белка. При этом наблюдается уменьшение его растворимости, изменение формы и размеров молекул. Так, соли тяжелых металлов при взаимодействии с белками образуют нерастворимые соединения, и белки выпадают в осадок.
). Процесс нарушения природной структуры белков под влиянием каких-либо факторов без разрушения первичной структуры называется денатурацией (от лат. де — приставка, означающая утрату, натура — природные свойства). Денатурация происходит вследствие разрыва водородных, ионных, дисульфидных и других связей, стабилизирующих пространственную структуру белковых молекул. При этом может утрачиваться их четвертичная, третичная и даже вторичная структура (рис. 10). Денатурация сопровождается потерей биологической активности белка. При этом наблюдается уменьшение его растворимости, изменение формы и размеров молекул. Так, соли тяжелых металлов при взаимодействии с белками образуют нерастворимые соединения, и белки выпадают в осадок.
Денатурация часто имеет необратимый характер. Однако в ряде случаев после непродолжительного воздействия повреждающего фактора белок может восстановить свое первоначальное состояние. Это явление называется ренатурацией (от лат. ре — приставка, означающая возобновление). Развернутая полипептид-ная цепь способна самопроизвольно закрутиться в спираль, а затем уложиться в третичную структуру. Это означает, что пространственная структура белка определяется его первичной структурой, т. е. последовательностью аминокислотных остатков.
ре — приставка, означающая возобновление). Развернутая полипептид-ная цепь способна самопроизвольно закрутиться в спираль, а затем уложиться в третичную структуру. Это означает, что пространственная структура белка определяется его первичной структурой, т. е. последовательностью аминокислотных остатков.
Явление денатурации часто используется в биологических исследованиях и в медицине. При определении в биологическом материале низкомолекулярных соединений из раствора сначала удаляют белки. Для этого вызывают их денатурацию, затем осаждают или отфильтровывают.
В медицине денатурацию применяют для стерилизации инструментов и материалов (здесь денатурирующим агентом является высокая температура). Такие денатурирующие агенты, как этиловый спирт, фенол и хлорамин, используют в качестве антисептиков для дезинфекции загрязненных материалов и поверхностей. Аналогичные процессы происходят при обеззараживании ран, ссадин, царапин раствором йода или спиртом.
Функции белков. Большое разнообразие белков позволяет им выполнять в живом организме множество различных функций.
Большое разнообразие белков позволяет им выполнять в живом организме множество различных функций.
Структурная функция. Белки входят в состав всех клеток и тканей живых организмов. Белки являются обязательным компонентом всех клеточных мембран и органоидов клетки. Из белков построены элементы цитоскелета, сократительные элементы мышечных волокон. Преимущественно из белков состоят хрящи и сухожилия. В их состав входит белок коллаген. Важнейшим структурным компонентом перьев, волос, ногтей, когтей, рогов, копыт у животных является белок кератин. В состав связок, стенок артерий и лёгких входит структурный белок эластин.
Ферментативная (каталитическая) функция. Многие белки являются ферментами. Ферменты — это биологические катализаторы, т. е. вещества, ускоряющие протекание химических реакций в живых организмах. Ферменты участвуют в процессах синтеза и расщепления различных веществ. Они обеспечивают фиксацию углерода в процессе фотосинтеза, расщепление питательных веществ в пищеварительном тракте и т. д.
д.
Практически все процессы жизнедеятельности, протекающие в организме, обусловлены ферментативными реакциями.
Ферменты ускоряют химические реакции за счет тесного взаимодействия с молекулами субстратов — исходных реагирующих веществ (рис. 11). С субстратом (или субстратами) взаимодействует не вся молекула фермента, а лишь небольшой ее участок — активный центр. Чаще всего он образован несколькими аминокислотными остатками. Форма и химическое строение активного центра таковы, что с ним могут связываться только определенные субстраты из-за соответствия их пространственных структур. Иными словами, субстрат по форме подходит к активному центру, как ключ к замку. Присоединение к активному центру приводит к тому, что молекулы субстрата определенным образом располагаются в пространстве и деформируются, в их структуре ослабляются определенные химические связи. Все это приводит к ускорению реакции.
На заключительном этапе химической реакции фермент-субстратный комплекс распадается с высвобо>вдением конечных продуктов и свободного фермента. Освободившийся активный центр может принимать новые молекулы субстрата.
Освободившийся активный центр может принимать новые молекулы субстрата.
Сходство ферментов с обычными химическими катализаторами проявляется в том, что и те и другие увеличивают скорость реакции, но при этом не расходуются и могут использоваться многократно.
В отличие от обычных химических катализаторов ферменты обладают специфичностью, т. е. каждый фермент ускоряет только одну определенную реакцию или действует только на определенный тип связи. Эта особенность объясняется соответствием активного центра фермента определенным субстратам. Ферменты работают гораздо быстрее (ускоряют реакции в миллионы и миллиарды раз, а неорганические катализаторы — в сотни и тысячи раз), поэтому даже в очень малых концентрациях обеспечивают интенсивное протекание катализируемых реакций.
Ферменты являются белками, поэтому активно работают лишь в определенном диапазоне pH, температуры и других факторов. Например, фермент желудочного сока пепсин активен только в кислой среде, а ферменты слюны амилаза и мальтаза — в слабощелочной. При повышении температуры все химические реакции ускоряются, а реакции, катализируемые ферментами, замедляются, а затем вовсе прекращаются. Повышение температуры, изменение кислотности среды и других факторов приводит к денатурации ферментов, в результате чего они теряют способность связываться со своими субстратами.
При повышении температуры все химические реакции ускоряются, а реакции, катализируемые ферментами, замедляются, а затем вовсе прекращаются. Повышение температуры, изменение кислотности среды и других факторов приводит к денатурации ферментов, в результате чего они теряют способность связываться со своими субстратами.
Некоторые ферменты, помимо активного центра, имеют один или несколько регуляторных центров. Как с активным, так и с регуляторным центрами могут связываться определенные вещества, влияющие на активность фермента. Вещества, повышающие скорость ферментативных реакций, называются активаторами (от лат. активус — деятельностный).
Вещества, снижающие или блокирующие активность ферментов, называются ингибиторами (от лат. ингибео — сдерживаю, останавливаю).
Различают несколько типов ингибирования, в частности, конкурентное и неконкурентное (рис.12).
Конкурентное ингибирование вызывается веществами, которые по структуре сходны с субстратом и способны связываться с активным центром фермента. При этом молекулы субстрата и ингибитора конкурируют за активный центр. Конкурентные ингибиторы нередко используются в качестве лекарственных средств (антибиотики, противоопухолевые препараты и др.).
При этом молекулы субстрата и ингибитора конкурируют за активный центр. Конкурентные ингибиторы нередко используются в качестве лекарственных средств (антибиотики, противоопухолевые препараты и др.).
Неконкурентные ингибиторы не имеют структурного сходства с субстратом и присоединяются не к активному центру, а к другим участкам фермента (в частности, к регуляторному центру).
Ферменты широко используются в пищевой промышленности (при производстве сыров, соков, овощных и фруктовых пюре, в хлебопечении, пивоварении, виноделии, для обработки мяса и т. д.). Их также применяют в сельском хозяйстве для получения кормов, в медицине для диагностики и лечения заболеваний, в текстильной и кожевенной промышленности для обработки тканей, кожи и меха, в производстве синтетических моющих средств и др.
Транспортная функция. Многие белки способны присоединять и переносить различные вещества. Гемоглобин связывает и переносит кислород и углекислый газ. Альбумины крови транспортируют жирные кислоты, глобулины — ионы металлов и гормоны. Многие белки, входящие в состав цитоплазматической мембраны, участвуют в транспорте веществ в клетку и из нее.
Многие белки, входящие в состав цитоплазматической мембраны, участвуют в транспорте веществ в клетку и из нее.
Сократительная (двигательная) функция. Сократительные белки обеспечивают способность клеток, тканей, органов и целых организмов изменять форму, двигаться. Так, актин и миозин обеспечивают работу мышц и немышечные внутриклеточные сокращения. Белок тубулин входит в состав микротрубочек веретена деления, ресничек и жгутиков эукариотических клеток.
Регуляторная функция. Некоторые пептиды и белки являются гормонами. Они влияют на различные физиологические процессы. Например, инсулин и глюкагон регулируют содержание глюкозы в крови, а соматотропин (гормон роста) — процессы роста и физического развития.
Сигнальная функция. Некоторые белки клеточных мембран способны изменять свою структуру в ответ на действие внешних факторов. С помощью этих белков происходит прием сигналов из внешней среды и передача информации в клетку. Примером может служить опсин — составная часть зрительного пигмента родопсина, содержащегося в клетках сетчатки глаза.
Примером может служить опсин — составная часть зрительного пигмента родопсина, содержащегося в клетках сетчатки глаза.
Защитная функция. Белки предохраняют организм от вторжения чужеродных организмов и от повреждений. Так, в ответ на проникновение чужеродных объектов (антигенов) определенные лейкоциты вырабатывают специфические белки — иммуноглобулины (антитела), участвующие в иммунном ответе организма. Белок интерферон защищает организм от вирусной инфекции. Фибриноген, тромбопластин и тромбин обеспечивают свертывание крови, предотвращая кровопотерю.
Токсическая функция. Многие живые организмы выделяют белки-токсины, которые являются ядами для других организмов. Токсины синтезируются в организме ряда животных, грибов, растений, микроорганизмов. В свою очередь, некоторые организмы способны вырабатывать антитоксины, которые подавляют действие этих ядов.
Энергетическая функция. После расщепления до аминокислот белки могут служить источником энергии в клетке. При полном окислении 1 г белка выделяется 17,6кДж энергии. Однако белки расходуются на энергетические нужды лишь в крайних случаях, когда исчерпаны запасы углеводов и жиров.
При полном окислении 1 г белка выделяется 17,6кДж энергии. Однако белки расходуются на энергетические нужды лишь в крайних случаях, когда исчерпаны запасы углеводов и жиров.
Запасающая функция. В семенах растений запасаются резервные белки, которые используются при прорастании зародышем, а затем и проростком как источник азота.
1. Как называется процесс нарушения природной структуры белка, при котором сохраняется его первичная структура? Действие каких факторов может приводить к нарушению структуры белковых молекул?
2. Чем фибриллярные белки отличаются от глобулярных? Приведите примеры фибриллярных и глобулярных белков.
3. Назовите основные биологические функции белков, приведите соответствующие примеры.
4. Что такое ферменты? Почему без их участия протекание большинства биохимических процессов в клетке было бы невозможным?
5. В чем заключается специфичность ферментов? Какова ее причина? Почему ферменты активно функционируют лишь в определенном диапазоне температуры, pH и других факторов?
6. Почему белки, как правило, используются в качестве источников энергии лишь в крайних случаях, когда в клетках исчерпаны запасы углеводов и жиров?
Почему белки, как правило, используются в качестве источников энергии лишь в крайних случаях, когда в клетках исчерпаны запасы углеводов и жиров?
7. У многих бактерий в процессах синтеза веществ, необходимых для нормального роста и размножения, участвует парааминобензойная кислота (ПАБК). В то же время в медицине для лечения ряда бактериальных инфекций используются сульфаниламиды — вещества, по структуре сходные с ПАБК. Как вы думаете, на чем основано лечебное действие сульфаниламидов?
Биология: учеб. для 10-го кл. учреждений общ. сред, образования с рус. яз. обуч. / Н. Д. Лисов [и др.]; под ред. Н. Д. Лисова. — 3-е изд., перераб. — Минск : Народная асвета, 2014. — 270 с.: ил.
Функции белков
Урок 7. Введение в общую биологию и экологию 9 класс ФГОС
Из этого урока вы узнаете о разнообразии функций, выполняемых белками в живых организмах. Приводятся примеры конкретных белков, влияющих на различные процессы жизнедеятельности. Основные понятия: биологические катализаторы, ферменты
Основные понятия: биологические катализаторы, ферменты
Конспект урока «Функции белков»
Перед
подробным изучением роли белков, давайте вспомним функции углеводов и липидов.
Углеводы:
структурная, энергетическая и запасающая. Итого три.
У липидов побольше: те же энергетическая, запасающая и структурная. Плюс
специфические: защитная, теплоизоляционная и регуляторная. Итого шесть.
А
что с белками? Забегая вперёд, скажем, что у белков их около десяти. Почему так
много? Нетрудно догадаться.
Из
предыдущих уроков вы знаете, что белки имеют более сложное строение и
отличаются огромным разнообразием. А поэтому и выполняют в живых организмах
чрезвычайно важные и многообразные функции.
Итак,
проследим за работой этих трудяг и выясним, почему же именно они являются
незаменимыми составляющими жизни.
Начнём
с самой основополагающей и солидной функции – строительной, или структурной.
Белки
являются неотъемлемой составляющей всех клеток, всех тканей всех живых
организмов. Как вы помните, вместе с фосфолипидами они входят в состав
Как вы помните, вместе с фосфолипидами они входят в состав
цитоплазматических мембран. Из белков построен цитоскелет
клетки, о котором подробнее вы узнаете совсем скоро, мышечные волокна также
представлены белками. Белок коллаген является основным элементом
хрящей и сухожилий. Кстати, коллаген –
лидер среди белков у млекопитающих. Его содержание в организме может достигать
до 35% от всех белков.
Кератин – важнейший структурный компонент перьев, ногтей, рогов,
волос, копыт у животных.
В
составе связок, лёгких, в стенках артерий мы обнаружим белок эластин.
Следующая
функция по важности мало уступает первой. Но если структурная не таит в себе каких-либо
особых секретов, то ферментативная, или каталитическая – и
сегодня загадка для учёных. Здесь речь идёт о тех белках, которые способны
ускорять химические реакции, выступая в роли катализаторов. Или
точнее – биологических катализаторов. Называются они ферментами и
способны увеличивать скорость протекания химической реакции в миллионы и
миллиарды раз. Только вдумайтесь! Неорганическим катализаторам такие
Только вдумайтесь! Неорганическим катализаторам такие
способности и не снились. Их эффективность ограничивается сотнями и тысячами
раз.
Подробнее
с теорией, которая описывает механизм работы ферментов, вы познакомитесь
немножко позже.
Далее
транспортная функция. Многие белки обладают способностью легко
присоединять к себе различные вещества, переносить и легко отдавать в нужном
месте. Первым примером такого белка, который мы сразу вспомним, будет, конечно
же, гемоглобин эритроцитов позвоночных животных. Он связывает и переносит
кислород. Ну и немножко углекислый газ.
Жирные
кислоты в организме транспортируются альбуминами крови.
Глобулины переносят ионы металлов и гормоны.
Белки цитоплазматической мембраны обеспечивают транспорт веществ в клетку и из
неё.
Сократительная,
или двигательная функция. Мы знаем, что одним из признаков живых существ
является способность к движению. Передвигаться могут отдельные клетки, ткани,
органы и целые организмы. В основе работы мышц, а также внутриклеточных
В основе работы мышц, а также внутриклеточных
сокращений лежит способность изменять свои размеры белков актина
и миозина. А белок тубулин
обеспечивает перемещение хромосом при делении клетки, движение ресничек и
жгутиков эукариотических клеток.
Пептиды
и белки могут выполнять и роль гормонов, изменяя скорость протекания различных
физиологических процессов. Выполняя регуляторную функцию.
Как вы помните из восьмого класса, инсулин
и глюкагон поддерживают постоянную концентрацию глюкозы в крови.
А гормон роста соматотропин отвечает,
соответственно, за рост и физическое развитие вашего организма.
Сигнальная
функция. Некоторые белки, входящие в состав плазмалеммы, могут изменять свою
структуру под действием различных внешних факторов. Тем самым они обеспечивают
приём сигналов из внешней среды и передают полученную информацию в клетку.
Помните, как работает наше зрение? При попадании света на светочувствительный
пигмент родопсин, он распадается. В ответ на появление продуктов
В ответ на появление продуктов
распада родопсина возникает нервный импульс, который и формирует зрительные
ощущения. Так вот, составляющая пигмента родопсина – белок опсин.
Существуют
белки, которые стоят на страже целостности организмов. Они способны защищать
внутреннюю среду от повреждений и вторжения чужеродных тел. Любой живой
организм постоянно подвержен проникновению незваных объектов (антигенов). Но в
здоровом организме незваные гости быстро нейтрализуются при помощи лейкоцитов.
Последние
вырабатывают специальные белки – иммуноглобулины (антитела),
которые подавляют деятельность антигенов. Тем самым обеспечивая иммунный ответ.
Например, от вирусных инфекций защищает белок интерферон. А от
чрезмерной потери крови – фибриноген, тромбопластин
и тромбин. Обеспечивая её свёртывание.
Токсическая
функция. Белки могут не только защищаться, но и нападать.
Хотя защита – это тоже нападение.
Многие живые существа способны вырабатывать и выделять белки-токсины.
Это характерно для ряда животных, а особенно грибов, растений, микроорганизмов.
Например, пептидную природу имеет дифтерийный токсин. Возможно, вы слышали о
нём. Вырабатывается бактерией Corynebacterium diphtheriae (бацилла
Лёффлера) и нарушает синтез белков.
В ответ на проникновение белков-токсинов, некоторые организмы способны
вырабатывать антитоксины, подавляющие действие ядов. А если такие антитоксины
не вырабатываются, то их можно ввести. При укусе той же змеи спасают жизнь
человеку, вводя специфический антитоксин. Но только специфический. То есть для
каждой змеи свой.
Запасающая
функция. В первую очередь эту функцию выполняют, как мы уже сказали,
углеводы и жиры. Но в семенах растений запасаются именно резервные белки.
Зачем? Для прорастания зародыша нужен азот. А углеводы и липиды азота, как
известно, не содержат. Вот почему семена некоторых растений (бобовые) содержат
даже полноценные белки, заменяющие мясо.
Энергетическая
функция. Несмотря на свою ценность, в крайних случаях белки
Несмотря на свою ценность, в крайних случаях белки
могут выступать и всего лишь источником энергии для организма. Но происходит
это только тогда, когда расходовались все углеводы и жиры. Как и углеводы,
белки при расщеплении 1 грамма дают 17,6 кДж энергии.
Предыдущий урок 6
Состав и строение белков
Следующий урок 8
Нуклеиновые кислоты: строение и функции
Получите полный комплект видеоуроков, тестов и презентаций
Введение в общую биологию и экологию 9 класс ФГОС
Чтобы добавить комментарий зарегистрируйтесь или войдите на сайт
Белковые токсины — Creative Biolabs
- Домашний
- Услуги
- Универсальная служба разработки ADC
- Индивидуальный синтез DrugLnk™
- Модуль лекарств
- Белковые токсины
Являясь лидером в разработке и производстве рекомбинантных антител, Creative Biolabs теперь предлагает услуги по интеграции белковых токсинов в полные антитела, области Fab антител, scFv, однодоменные антитела… в качестве новой формы конъюгатов антитело-лекарственное средство (ADC) для целевых разработок лекарств. .
.
Белковые токсины обычно вырабатываются бактериями или растениями. Многие бактериальные токсины состоят из двух частей: клеточно-связывающая часть взаимодействует с клеточной поверхностью, а ферментативная часть проникает в цитозоль и вызывает токсичность. Обычные белковые токсины включают экзотоксин псевдомонад (PE), дифтерийный токсин (DT) и белки, инактивирующие рибосомы (RIP). Белковые токсины являются потенциальными кандидатами на полезную нагрузку для конъюгатов иммунотоксинов (ITC) и ADC.
Пути гибели клеток, опосредованной белковым токсином. Белковые токсины проникают в клетки-мишени посредством рецептор-опосредованного эндоцитоза и вызывают гибель клеток, ингибируя биосинтез белка (9).0021 Кровь, 2014).
Дифтерийный токсин (DT)
DT представляет собой внеклеточный белок из Corynebacterium diphtheriae , который ограничивает синтез белка и убивает подозрительные клетки. Подтверждено, что важным фактором механизма синтеза белка, сдерживаемым DT, является фактор элонгации 2 (EF-2), в то время как присутствие никотинамидадениндинуклеотида (NAD) необходимо для ингибирования синтеза белка DT.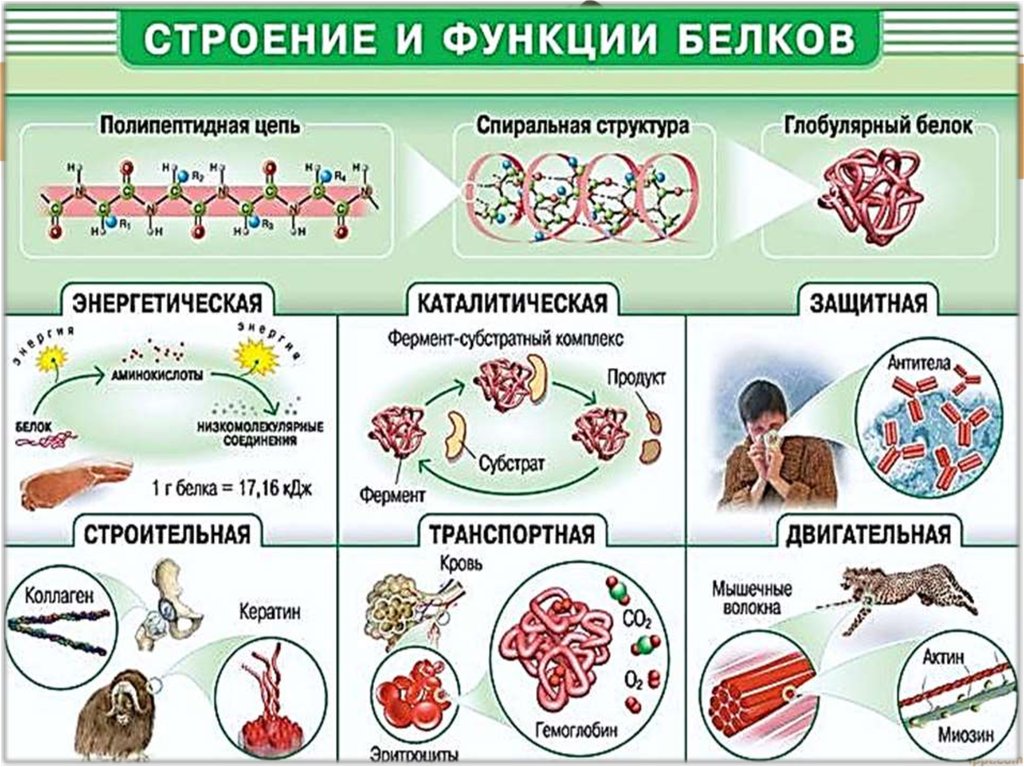 Кроме того, было доказано, что DT действует каталитически путем переноса части аденозиндифосфатрибозы (ADPR) от NAD к EF-2, тем самым инактивируя EF-2 и ограничивая удлинение цепи во время синтеза белка. OXS-1550, биспецифический рекомбинантный слитый белок scFv, был разработан в качестве новой терапии для лечения лейкемии и лимфомы. Он состоит из модифицированной формы DT в качестве полезной лекарственной нагрузки и вариабельных областей тяжелой и легкой цепей анти-CD19.и анти-CD22-антитела соответственно. OXS-1550 показал хорошую эффективность в ранних клинических испытаниях против рецидивирующей и рефрактерной В-клеточной лимфомы или лейкемии.
Кроме того, было доказано, что DT действует каталитически путем переноса части аденозиндифосфатрибозы (ADPR) от NAD к EF-2, тем самым инактивируя EF-2 и ограничивая удлинение цепи во время синтеза белка. OXS-1550, биспецифический рекомбинантный слитый белок scFv, был разработан в качестве новой терапии для лечения лейкемии и лимфомы. Он состоит из модифицированной формы DT в качестве полезной лекарственной нагрузки и вариабельных областей тяжелой и легкой цепей анти-CD19.и анти-CD22-антитела соответственно. OXS-1550 показал хорошую эффективность в ранних клинических испытаниях против рецидивирующей и рефрактерной В-клеточной лимфомы или лейкемии.
Конструирование DT2219EA, слитого белка биспецифического антитело-DT.
Исходная конструкция DT2219EA, состоящая из первых 389 аминокислот DT, областей VH и VL анти-CD22.
(sFv) и анти-CD19, связанные 20-аминокислотным сегментом мышечной альдолазы человека (hma). Для производства ДТ2219АРЛ,
исходная ориентация VH-VL была изменена на противоположную, и гены VL и VH каждого sFv были соединены
фрагмент, кодирующий линкер ARL. Конечный целевой ген был сплайсирован в вектор pET21d.
Конечный целевой ген был сплайсирован в вектор pET21d.
Дорожка 2 части B представляет собой DT2219ARL, около 95 кДа ( Leukemia Res, 2009).
Экзотоксин Pseudomonas (PE)
PE представляет собой экзотоксин, продуцируемый Pseudomonas aeruginosa и принадлежит к семейству двухкомпонентных токсинов AB, которые содержат домен A с ферментативной активностью и домен B в качестве субъединицы, связывающейся с клеткой. PE имеет чрезвычайно гидрофобный лидерный пептид из 25 а.о. на его N-конце, за которым следует рецептор-связывающий домен Ia (1-252 а.о.), который состоит из антипараллельных β-листов. Вторая часть PE, домен II (а.о. 253–364), содержит шесть последовательных α-спиралей и обеспечивает транслокацию токсина через клеточные мембраны. PE также влияет на синтез белка, ограничивая EF-2 посредством АДФ-рибозилирования, что приводит к прекращению удлинения полипептидов. PE был применен в направленной противораковой терапии с двумя слитыми белками scFv-PE, которые в настоящее время проходят клиническую оценку.
Терапевтические антитела, полученные путем слияния scFv анти-CD22 с экзотоксином А псевдомонад и мутантной версией экзотоксина А псевдомонад. Оба конъюгата проявляют одинаковую цитотоксичность в отношении CD22 + раковых клеток в опухолях vitro и СА46 in vivo ( ПНАС, 2012 г.).
Белок, инактивирующий рибосомы (RIP)
Белки, инактивирующие рибосомы (RIP), включая рицин, абрин, сапорины и др., являются каталитическими токсинами, необратимо инактивирующими синтез белка. Большинство RIP были выделены из растений, а также обнаружены в грибах, водорослях и бактериях. Было продемонстрировано, что они проявляют РНК-N-гликозидазную активность и депуринируют 28S рРНК большой 60S рибосомной субъединицы в эукариотических клетках. Среди этих RIP токсин рицин, полученный из Ricinus communis наиболее подробно изучался как цитотоксическая полезная нагрузка. Например, комботокс, ADC, состоит из двух мышиных моноклональных антител IgG1: антитела к CD22 (RFB4) и антитела к CD19 (HD37), каждое из которых индивидуально конъюгировано с токсином на основе рицина: дегликозилированная цепь рицина-А (dgRTA). , через гетеробифункциональный тиолсодержащий сшивающий агент. Было показано, что Combotox эффективен на мышиной модели лимфомы Дауди (CD19+/CD22+) SCID, а комбинированное использование антител выявило синергетический эффект уничтожения.
, через гетеробифункциональный тиолсодержащий сшивающий агент. Было показано, что Combotox эффективен на мышиной модели лимфомы Дауди (CD19+/CD22+) SCID, а комбинированное использование антител выявило синергетический эффект уничтожения.
Используя наши хорошо зарекомендовавшие себя платформы для разработки рекомбинантных антител и платформы органического синтеза «DrugLnk», опытные ученые Creative Biolabs стремятся помочь нашим клиентам своевременно и с минимальными затратами разработать препараты, нацеленные на антитела, содержащие белковый токсин. Наши индивидуально подобранные услуги и высококачественная продукция внесут большой вклад в успех ваших проектов.
Creative Biolabs также предоставляет различные услуги по разработке АЦП. Пожалуйста, не стесняйтесь обращаться к нам за дополнительной информацией и подробным предложением.
Каталожные номера:
- Мерфи, младший; и др. . Механизм доставки каталитического домена дифтерийного токсина в цитозоль эукариотической клетки и клеточные факторы, непосредственно участвующие в этом процессе.
 Токсины. 2011, 3(3): 294-308.
Токсины. 2011, 3(3): 294-308. - Михальская, М .; и др. . Pseudomonas Exotoxin A: оптимизирован в процессе эволюции для эффективного уничтожения. Фронт Микробиол . 2015, 6:963.
- Уолш, MJ; и др. Белки, инактивирующие рибосомы: сильнодействующие яды и молекулярные инструменты. Вирулентность. 2013, 4(8): 774-784.
- Валлера, Д.А.; и др. . Генетическое изменение биспецифического лиганд-направленного токсина, нацеленного на человеческие рецепторы CD19 и CD22, приводящее к повышению эффективности против системных В-клеточных злокачественных новообразований. Лейкемия Рез. 2009, 33(9): 1233-1242.
- Уэйн, AS; и др. . Иммунотоксины при лейкозах. Кровь . 2014, 123:2470-2477.
- Лю, В .; и др. . Рекомбинантный иммунотоксин, разработанный для обеспечения низкой иммуногенности и антигенности путем идентификации и подавления эпитопов В-клеток человека.
 ПНАС . 2012, 109(29): 11782–11787.
ПНАС . 2012, 109(29): 11782–11787.
Только для исследовательских целей. НЕ ДЛЯ КЛИНИЧЕСКОГО ИСПОЛЬЗОВАНИЯ.
Прочие лекарственные препараты:
- Токсины микротрубочек
- ДНК-токсины
- Транскрипционные токсины
- Наноносители
- Токсичные ферменты/ADEPT
- Ингибиторы
Связанные разделы
Индивидуальный синтез DrugLnk™:
Модуль препарата
Линкерный модуль
Универсальная служба разработки ADC:
ADC Скрининг антител
Индивидуальный синтез DrugLnk™
Дизайн и конъюгация антител
ADC Анализ 100em in vitro 100em>in vitro >in vivo Анализ
Производство ADC
Услуги:
Универсальная служба разработки ADC
Конъюгаты антитело-антибиотик (AAC)
Биополимерные конъюгаты антител (ABC)
антитело-иммуностимуляционные конъюгаты
Службы развития антител-олигонуклеотидных конъюгатов (AOC)
Конъюгаты антител-анцим.
Имя:
*Телефон:
*Адрес электронной почты:
* Заинтересованные продукты или услуги:
Компания/Учреждение
Описание проекта:
Добро пожаловать! Чтобы узнать цену, пожалуйста, свяжитесь с нами через форму слева. Мы свяжемся с вами как можно скорее.
Свяжитесь с нами
США
Тел:
Факс:
Эл. адрес:
Европа
Тел:
Эл. адрес:
адрес:
Подпишитесь на нашу рассылку новостей и подкасты для получения обновлений:
Белок, который может быть токсичным для сердца и нервов, может помочь предотвратить болезнь Альцгеймера: Отдел новостей
Аномальные отложения белка бета-амилоида в головном мозге связаны с болезнью Альцгеймера. На приведенной выше иллюстрации показан потенциальный способ, обнаруженный исследователями UTSW, чтобы остановить этот процесс, используя защитную природу белка транстиретина (TTR) для идентификации сегмента этого белка, TTR-S, который останавливает образование зубного налета и облегчает его деградацию в тесте. трубка.
Предоставлено: UT Southwestern
ДАЛЛАС — 7 января 2021 г. — Белок, который наносит ущерб нервам и сердцу, когда он слипается, может предотвратить образование токсичных белковых скоплений, связанных с болезнью Альцгеймера, новое исследование под руководством UT Southwestern показывает исследователь. Результаты, недавно опубликованные в Journal of Biological Chemistry , могут привести к новым методам лечения этого разрушительного для мозга состояния, для которого в настоящее время нет действительно эффективных методов лечения и лечения.
Результаты, недавно опубликованные в Journal of Biological Chemistry , могут привести к новым методам лечения этого разрушительного для мозга состояния, для которого в настоящее время нет действительно эффективных методов лечения и лечения.
Исследователям давно известно, что липкие бляшки белка, известного как бета-амилоид, являются признаком болезни Альцгеймера и токсичны для клеток головного мозга. Еще в середине 1990-х годов в этих бляшках были обнаружены и другие белки.
Лорена Сэлисис, доктор философии.
Один из них, белок, известный как транстиретин (TTR), по-видимому, играет защитную роль, объясняет Лорена Сэлисис, доктор философии, доцент кафедры биофизики в Центре болезни Альцгеймера и нейродегенеративных заболеваний при UTSW, центре, который является частью Института мозга Питера О’Доннелла-младшего. Когда мыши, у которых была смоделирована болезнь Альцгеймера, были генетически изменены, чтобы производить больше TTR, у них медленнее развивалось состояние, подобное болезни Альцгеймера; точно так же, когда они производили меньше TTR, у них быстрее развивалось состояние.
У здоровых людей и животных, добавляет Сэлисис, TTR помогает транспортировать гормон щитовидной железы и ретинол, производное витамина А, туда, где они необходимы в организме. Для этой работы TTR образует тетрамер — форму, похожую на клевер с четырьмя одинаковыми листочками. Однако, когда он разделяется на молекулы, называемые мономерами, эти отдельные фрагменты могут действовать как бета-амилоид, образуя липкие фибриллы, которые соединяются в токсичные скопления в сердце и нервах, вызывая редкое заболевание амилоидоз. В этом состоянии амилоидный белок накапливается в органах и нарушает их функцию.
Сэлисис задался вопросом, может ли быть связь между отдельными ролями TTR как в предотвращении, так и в возникновении заболеваний, связанных с амилоидами. «Казалось таким совпадением, что у TTR были такие противоположные функции», — говорит она. «Как это может быть одновременно и защитным, и разрушительным?»
Чтобы изучить этот вопрос, она и ее коллеги разработали девять различных вариантов TTR с различной склонностью к разделению на мономеры, которые объединяются, образуя липкие фибриллы. Кто-то делал это быстро, в течение нескольких часов, а кто-то медленно. Третьи были чрезвычайно стабильны и вообще не диссоциировали на мономеры.
Кто-то делал это быстро, в течение нескольких часов, а кто-то медленно. Третьи были чрезвычайно стабильны и вообще не диссоциировали на мономеры.
Когда исследователи смешали эти варианты TTR с бета-амилоидом и поместили их на нейронные клетки, они обнаружили резкие различия в том, насколько токсичным остается бета-амилоид. Варианты, которые разделялись на мономеры и быстро агрегировались в фибриллы, обеспечивали некоторую защиту от бета-амилоида, но она была недолговечной. Те, которые разделялись на мономеры, но агрегировались дольше, обеспечивали значительно более длительную защиту. А те, которые никогда не отделялись, вообще не защищали от бета-амилоида.
Сэлисес и ее коллеги подозревали, что часть TTR связывается с бета-амилоидом, предотвращая образование бета-амилоидом собственных скоплений. Однако эта важная часть TTR, по-видимому, была скрыта, когда этот белок находился в тетрамерной форме. Разумеется, компьютерные исследования показали, что часть этого белка, скрытая при соединении листочков, может прикрепляться к бета-амилоиду. Однако этот кусок имел тенденцию прилипать к самому себе, быстро образуя комки. После модификации этого фрагмента химическими метками, чтобы остановить самоассоциацию, исследователи создали пептиды, которые могут предотвратить образование токсичных бета-амилоидных скоплений в растворе и даже разрушить предварительно сформированные бета-амилоидные бляшки. Взаимодействие модифицированных пептидов TTR с бета-амилоидом приводило к превращению их в формы, называемые аморфными агрегатами, легко разрушаемыми ферментами. Кроме того, модифицированные пептиды предотвращали «засев» амилоида — процесс, при котором фибриллы бета-амилоида, извлеченные из пациентов с болезнью Альцгеймера, могут формировать новые фибриллы.
Однако этот кусок имел тенденцию прилипать к самому себе, быстро образуя комки. После модификации этого фрагмента химическими метками, чтобы остановить самоассоциацию, исследователи создали пептиды, которые могут предотвратить образование токсичных бета-амилоидных скоплений в растворе и даже разрушить предварительно сформированные бета-амилоидные бляшки. Взаимодействие модифицированных пептидов TTR с бета-амилоидом приводило к превращению их в формы, называемые аморфными агрегатами, легко разрушаемыми ферментами. Кроме того, модифицированные пептиды предотвращали «засев» амилоида — процесс, при котором фибриллы бета-амилоида, извлеченные из пациентов с болезнью Альцгеймера, могут формировать новые фибриллы.
Сэлис и ее коллеги в настоящее время проверяют, может ли этот модифицированный пептид TTR предотвращать или замедлять прогрессирование болезни Альцгеймера на моделях мышей. По ее словам, если они добьются успеха, этот фрагмент белка может стать основой нового лечения этого неподатливого состояния.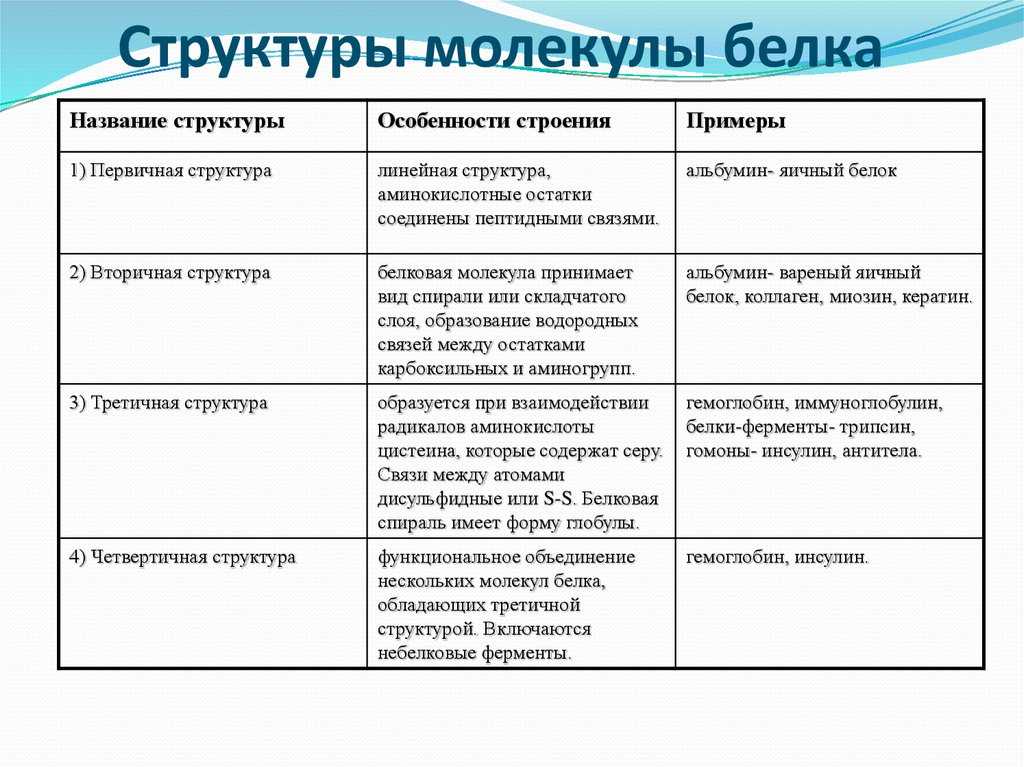

 Токсины. 2011, 3(3): 294-308.
Токсины. 2011, 3(3): 294-308. ПНАС . 2012, 109(29): 11782–11787.
ПНАС . 2012, 109(29): 11782–11787.