Содержание
Щелочная диета. Таблица щелочных и кислотных продуктов
81555
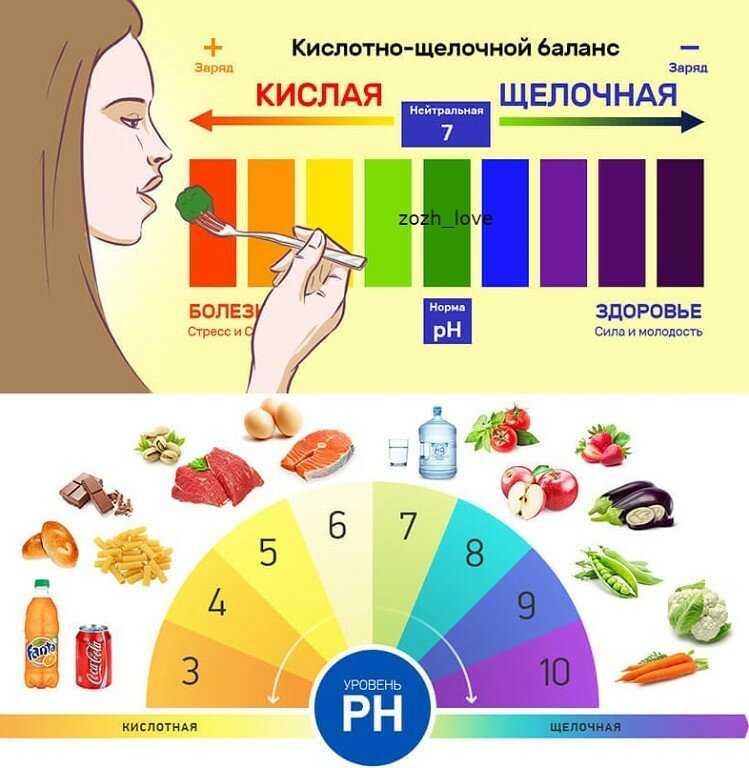
Чтобы разобраться в сути данного режима питания, представьте шкалу — на одном ее конце находится щелочь, на другом — кислота. Посередине расположились нейтральные вещества. Содержание щелочи изменяется в диапазоне от 0 до 14. Если pH какого-либо вещества больше 7, то оно щелочное, меньше 7 – кислотное, равно 7 — нейтральное.
Как известно, pH служит «водородным показателем», который определяет «изменение электрического сопротивления в организме между отрицательными и положительными ионами». Положительные ионы отвечают за образование кислоты, а отрицательные являются щелочнообразующими частицами. pH есть мера активности взаимодействия между ионами.
Оптимальный уровень pH для человеческого организма
Для поддержания нормальной (здоровой) работы организма человека уровень щелочи должен находится в диапазоне 7,4. Допустимы и следующие значения: 7,36 и 7,44.
Допустимы и следующие значения: 7,36 и 7,44.
Кровь хорошо справляется со своей работой (транспортировка кислорода и иных полезных веществ к органам и тканям) только в том случае, когда уровень pH находится в «правильном» диапазоне. Отклонения от нормативов приводит к негативным последствиям для здоровья человека. Чтобы этого не произошло необходимо соблюдать правильный баланс между щелочным и кислотным содержанием. Организм человека имеет щелочные запасы на случай нарушения данного баланса в пользу кислотносодержащих частиц. Но, как вы понимаете, они не бесконечны, поэтому надо их постоянно пополнять. Как это сделать? Очень просто. Нужно перейти на щелочную диету, а, если говорить простым языком, то необходимо включить в свой рацион продукты, имеющие высокий уровень содержания щелочи. К ним относятся свежие овощи и фрукты. Их список представлен чуть ниже.
Вреден ли излишек щелочи для человека? Нет, он резервируется для устранения кислот в будущем.
Причины нарушения кислотно-щелочного баланса
- неправильное питание,
- интенсивные физические нагрузки,
- малоподвижный образ жизни,
- стресс.

Самой главной причиной нарушения щелочного баланса в сторону кислотности служит питание. Рацион большинства современных людей состоит из сахара, углеводов, продуктов животного происхождения (мясо, молочные продукты), злаков и рафинированных масел. А они-то и образуют кислотность в организме. Данные продукты способны вырабатывать около 100mEq кислоты в день, в то время когда человек может переработать только половину. Для устранения кислоты приходят на помощь щелочные запасы, но вместе с ними отдаются и полезные для человека минералы.
Вред окисления организма
Как уже было сказано выше, чрезмерное количество кислоты и недостаток щелочи приводит к негативным последствиям для здоровья человека. Если тело не имеет необходимых элементов для подавления кислотности, то оно начинает заимствовать их из костей и важных тканей. В результате этого иммунитет человека падает, органы теряют способность к регенерации, что чревато появлением разных болезней, аллергии, мигрени, прыщей, проблем с желудком. Есть высокая вероятность того, что человек теряет в весе или наоборот набирает лишние килограммы.
Есть высокая вероятность того, что человек теряет в весе или наоборот набирает лишние килограммы.
В повышенной кислотности, как правило, размножаются вредные бактерии и раковые клетки. Но не все так страшно. Всего этого можно избежать, начав восстанавливать свой щелочной баланс за счет правильных продуктов питания.
Щелочная диета — восстановление кислотно-щелочного баланса
Реклама
Щелочная диета основа на употреблении достаточного количества продуктов, которые способствуют ощелачиванию организма. Благодаря такому рациону питания человек поддерживает свое здоровье на должном уровне и сохраняет красоту и молодость кожи.
Итак, какие же продукты следует есть для поддержания кислотно-щелочного баланса?
Таблица щелочных и кислотных продуктов
| Сильно защелачивающие | Защелачивающие | Слабо защелачивающие | Тип продуктов | Слабо закисляющие | Закисляющие | Сильно закисляющие |
|---|---|---|---|---|---|---|
| Свежий мёд, сахар-сырец | Сладости | Обработанный мёд, патока | Белый сахар, коричневый сахар | Nutra Sweet, Equal, аспартам, Sweeth Low | ||
| Лимон, арбуз, лайм, грейпфрут, манго, папайя | Финики, инжир, дыня, виноград, киви, яблоки, изюм, груши | Апельсины, бананы, черешня, ананас, персики, авокадо | Фрукты | Сливы консервированные, фруктовые соки | Вишня | Черника, клюква, чернослив |
| Спаржа, лук, овощные соки, петрушка, чеснок, шпинат, брокколи | Бамия, тыква, стручковая фасоль, свекла, сельдерей, салат, цуккини, батат | Морковь, помидоры, свежая кукуруза, грибы, капуста, горох, картофель скожурой, оливки, соевые бобы, тофу | Овощи и зернобобовые | Приготовленный шпинат, фасоль | Картофель без кожуры, пёстрая фасоль, белая фасоль, ревень | Какао, шоколад |
| Миндаль | Каштаны | Орехи и семечки | Семена тыквы, семена подсолнечника | Пекан, кешью | Арахис, грецкие орехи | |
| Льняное масло | Рапсовое масло | Масла | Кукурузное масло | |||
| Амарант, просо, дикий рис, киноа | Зерновые | Хлеб из пророщенной пшеницы, полба, коричневый рис | Белый рис, кукуруза, гречиха, овёс, рожь | Пшеница, белая мука, печенье, макароны | ||
| Мясо, рыба и морепродукты | Оленина, рыба из холодных морей | Индейка, курица, баранина | Говядина, свинина, моллюски | |||
| Грудное молоко | Соевый сыр, соевое молоко, козий сыр, сыворотка | Яйца и молочные продукты | Яйца, сливочное масло, йогурт, пахта, творог | Сырое молоко | Сыр, молоко, мороженое | |
| Травяные чаи, лимонная вода | Зеленый чай | Имбирный чай | Напитки | Черный чай | Кофе | Пиво |
*** Версия для печати
Как видно из таблицы, нет ничего общего между окисляющим и ощелачивающим воздействием продуктов на организм и реальным pH самой пищи.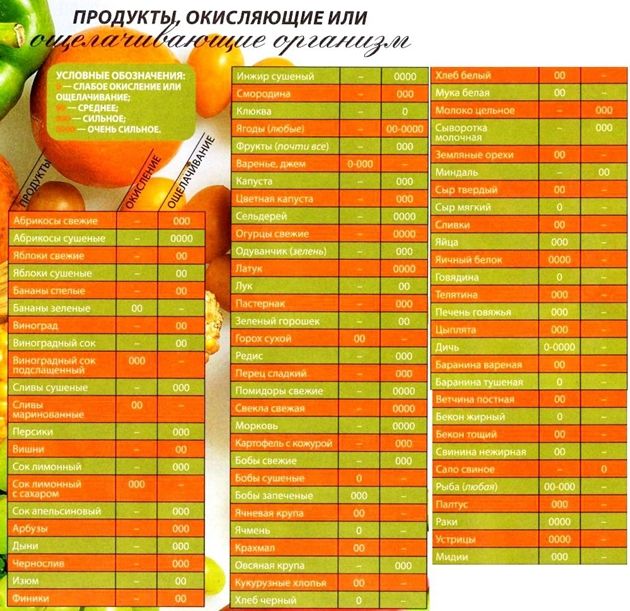 Для примера возьмем лимоны. Как известно, они весьма кислые, но после их переваривания и усвоения образуются конечные продукты, которые насыщены щелочами. Продукты животного происхождения, наоборот, содержат много щелочей, но во время переваривания оставляют кислый остаток.
Для примера возьмем лимоны. Как известно, они весьма кислые, но после их переваривания и усвоения образуются конечные продукты, которые насыщены щелочами. Продукты животного происхождения, наоборот, содержат много щелочей, но во время переваривания оставляют кислый остаток.
Топ-7 щелочных продуктов
Представляем вашему вниманию растительные продукты с самым высоким содержанием щелочи.
1. Лимоны. Они занимают первое место. Так что начинайте свой день со стакана лимонной водички, если хотите поправить свое здоровье.
2. Зелень славится своим высоким содержанием щелочи, витаминов и других полезных веществ.
3. Корнеплоды (например, морковка, свекла, репа) весьма положительно влияют на организм человека.
4. Огурцы и сельдерей. Эти продукты эффективно борются с кислотной средой и нормализуют работу пищеварения.
5. Чеснок. Ни для кого не секрет, что это растение прекрасно поддерживает иммунитет, устраняет вредные бактерии и грибки. Кроме того, чеснок является источником щелочи.
Кроме того, чеснок является источником щелочи.
Реклама
6. Крестоцветные овощи (белокочанная, цветная, брюссельская капуста и брокколи).
7. Авокадо приводит в норму щелочной баланс, насыщает организм витаминами, жирными кислотами и аминокислотами.
Следите за тем, что вы едите, если хотите избежать серьезных осложнений со здоровьем.
Новые комментарии
Реклама
Щелочные продукты питания: список и таблица кислотно-щелочная с процентами
Еда
14 мая, 2017
текст: My Handbook
Организм человека – настоящая химическая фабрика. В нем протекают тысячи биохимических процессов, от которых зависит здоровье и красота. Для того чтобы организм работал как часы, необходимы особые условия, в том числе правильный рацион. Одна из систем здорового питания – щелочная диета, нормализующая внутреннюю среду организма.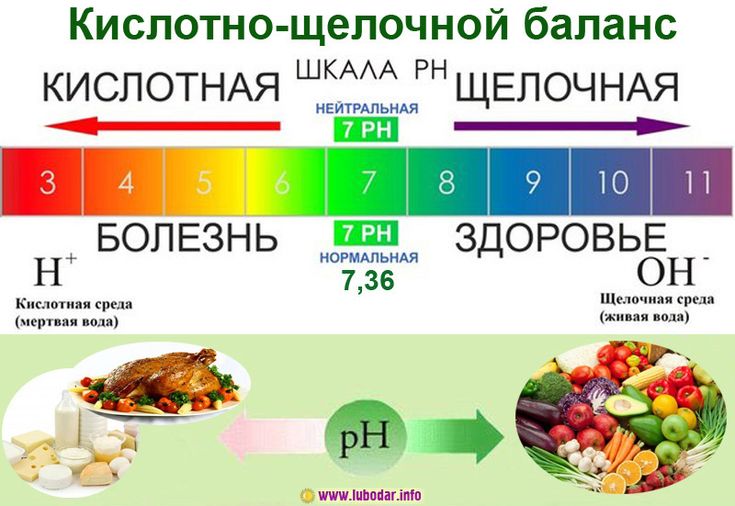 Как это происходит и какие продукты стоит включить в меню?
Как это происходит и какие продукты стоит включить в меню?
Сначала стоит разобраться с понятием кислотно-щелочного равновесия. Кислотно-щелочной баланс – это количество кислот и щелочей в какой-либо жидкости. Он выражается в pH: чем этот показатель ниже, тем кислее среда. Какое отношение это имеет к организму?
Дело в том, что внутри тела циркулируют различные жидкости: кровь, лимфа и межклеточное вещество. Они обеспечивают протекание биохимических реакций. Но лишь в том случае, если имеют правильный pH, который в норме должен быть щелочным. Например, для крови этот показатель составляет примерно 7.45. Кислотно-щелочное равновесие напрямую зависит от того, что человек ест: существуют кислотные и щелочные продукты питания. Очень часто различные недомогания (хроническая усталость, головные боли, плохое состояние кожи) связаны с закислением организма вследствие погрешностей в меню.
Список самых щелочных продуктов с процентами
Щелочные продукты, такие как авокадо, листовая зелень или большинство фруктов, обеспечивают наш организм необходимыми витаминами, минералами и являются надежным источником энергии. В то же время продукты животного происхождения или быстрые углеводы относятся к кислотной категории, а употреблять их стоит в умеренных количествах. Поддержка нужного pH в крови – не самый легкий процесс для нашего тела. Однако помочь организму очень легко, достаточно лишь сбалансировать своё питание. Представляем список самых щелочных продуктов, на которые непременно стоит сделать упор в ежедневном рационе.
В то же время продукты животного происхождения или быстрые углеводы относятся к кислотной категории, а употреблять их стоит в умеренных количествах. Поддержка нужного pH в крови – не самый легкий процесс для нашего тела. Однако помочь организму очень легко, достаточно лишь сбалансировать своё питание. Представляем список самых щелочных продуктов, на которые непременно стоит сделать упор в ежедневном рационе.
Продукты с pH 10: лимон, брюссельская капуста, шпинат, кимчи и другие ферментированные продукты.
Продукты с pH 9,5: арбуз, брокколи, картофельная кожура, капуста, свежие овощные соки, зелень горчицы, кейл.
Продукты с pH 9: хурма, ананас, свежие ягоды, мандарины, сливы, артишоки, свекла, сельдерей, огурцы, баклажан, краснокочанная капуста, батат, ямс, эндивий, соевые бобы, съедобные водоросли, необжаренные семена тыквы, кабачок, кресс-салат, кинза, петрушка, стевия, зеленый и травяной чай.
Продукты с pH 8,5: ежевика, дыня, абрикос, финики, инжир, грейпфрут, виноград, киви, нектарин, груша, папайя, маракуйя, изюм, проростки, морковь, имбирь, женьшень, зеленые бобы, лук, брюква, горошек, имбирный чай, кайенский перец, корица.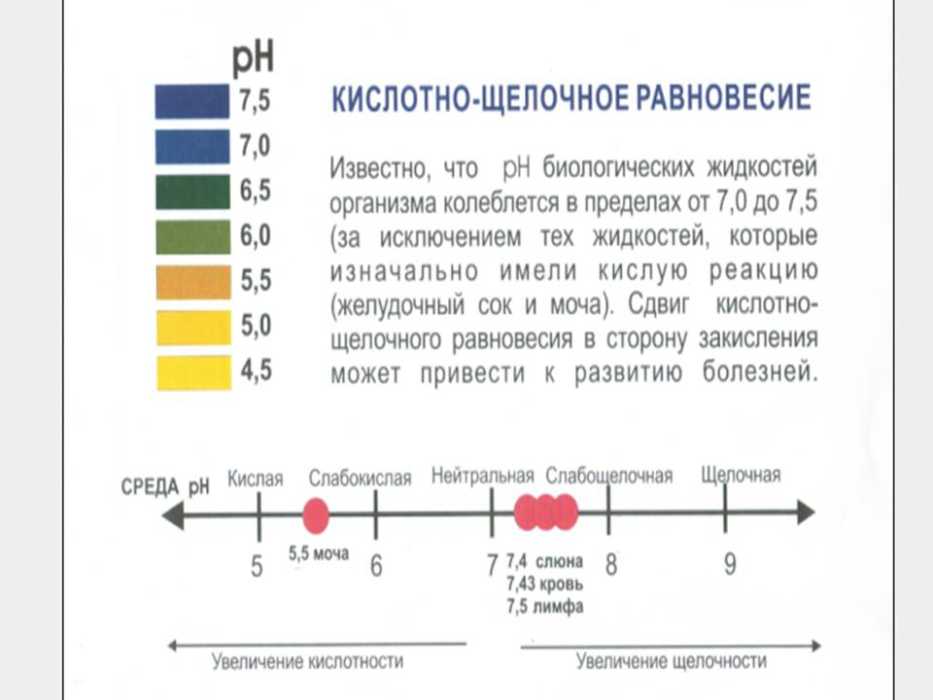
Продукты с pH 8: яблоки, смородина, крыжовник, спелые бананы, свежие апельсины, свежие персики, авокадо, болгарский перец, цветная капуста, капуста, свежие грибы, тыква, свежие спелые оливки, помидоры, дикий рис, кольраби, кунжутные семечки, миндаль, натуральные несладкие фруктовые соки, патока, мисо-суп, морская соль, яблочный уксус.
Продукты с pH 7,5: черника, свежий кокос, клюква, гуава, клубника, бамбуковые побеги, свекла без зелени, чеснок, вареная брюссельская капуста и брокколи, приготовленные кабачки и баклажаны, вареные соевые бобы, окра, картофель, редис, тофу, семена льна, пшено, полба, киноа, каштаны, масло авокадо, кленовый сироп.
Таблица 1: щелочные и кислотные продукты
В щелочной системе питания все продукты делятся на две большие группы:
- Кислотные – мясо, творог, сыр, молоко, десерты, выпечка, трансжиры, белый рис и пшеница, бобовые, яйца, черный чай, газировка, алкоголь.
- Щелочные – овощи, некоторые крупы, фрукты, мед, растительные масла, цельное зерно, козий сыр, пахта, травяные и зеленые чаи, миндаль, кокос.

Добиться нормализации кислотно-щелочного равновесия в организме очень просто – достаточно сократить в меню количество кислотных продуктов и увеличить долю щелочных. В современном мире наблюдается обратный перекос: люди усиленно употребляют кислотную пищу, каждый день едят мясо, заменяют натуральную пищу фастфудом, злоупотребляют сладким. Из-за этого человечество сталкивается с болезнями цивилизации: нарушениями обмена веществ, ожирением, сахарным диабетом, онкологией.
Основные принципы щелочной диеты
- Доля ощелачивающих продуктов в рационе должна составлять не менее 75-80%, а кислотных – не больше 20%.
- Крупы и зерновые едят не чаще трех раз в неделю, нежирное мясо и рыбу – не больше двух раз в неделю.
- Животные жиры необходимо по максимуму заменить на растительные масла.
- Нужно пить достаточное количество чистой воды, а также травяных настоев и чаев.
- В меню должны быть не только обработанные, но и сырые овощи и фрукты, богатые витаминами и клетчаткой.

- От кондитерских изделий, полуфабрикатов и фастфуда стоит отказаться полностью.
- В качестве десерта можно использовать сухофрукты, мед, кленовый сироп. В небольших количествах разрешено варенье и мороженое.
- Идеально 5 приемов пищи в день, небольшими порциями. Есть нужно не торопясь, тщательно пережевывая.
Таблица 2: щелочные и кислотные продукты (продолжение)
Таблица 3: щелочные продукты питания по Неумывакину И.П.
Диета с преобладанием щелочных продуктов способствует приливу энергии, улучшает состояние кожи и пищеварительной системы, способствует потере лишнего веса.
Перейти на щелочную диету очень легко тем, кто уже придерживается правильного питания. Для перехода с обычного рациона стоит постепенно сокращать процент кислотных продуктов и увеличивать долю ощелачивающих.
Фото: Alique
15.5 Кислотно-щелочной баланс – основы ухода за больными
Открытые ресурсы для сестринского дела (Open RN)
Как и в случае с электролитами, правильный баланс кислот и оснований в организме необходим для нормального функционирования организма. Даже небольшое отклонение от нормы может быть опасным для жизни, поэтому важно понимать нормальные кислотно-щелочные показатели, а также их причины и способы их исправления. Почки и легкие работают вместе, чтобы исправить небольшие дисбалансы по мере их возникновения. В результате почки компенсируют недостатки легких, а легкие компенсируют недостатки почек.
Даже небольшое отклонение от нормы может быть опасным для жизни, поэтому важно понимать нормальные кислотно-щелочные показатели, а также их причины и способы их исправления. Почки и легкие работают вместе, чтобы исправить небольшие дисбалансы по мере их возникновения. В результате почки компенсируют недостатки легких, а легкие компенсируют недостатки почек.
Газы артериальной крови
Газы артериальной крови (ABG) измеряют путем забора крови из артерии, а не из вены, и чаще всего собирают через лучевую артерию. ABG измеряют уровень pH крови, парциальное давление артериального кислорода (PaO2), парциальное давление артериального углекислого газа (PaCO2), уровень бикарбоната (HCO3) и уровень насыщения кислородом (SaO2).
Перед сбором газов крови важно убедиться, что у пациента есть достаточный приток артериальной крови к руке. Это делается путем выполнения теста Аллена. При выполнении теста Аллена давление сохраняется как на лучевой, так и на локтевой артерии ниже запястья. Давление сбрасывается из локтевой артерии, чтобы проверить, адекватен ли кровоток. Если артериальный кровоток адекватен, к руке должны вернуться теплота и цвет.
Давление сбрасывается из локтевой артерии, чтобы проверить, адекватен ли кровоток. Если артериальный кровоток адекватен, к руке должны вернуться теплота и цвет.
рН
pH — это шкала от 0 до 14, используемая для определения кислотности или щелочности вещества. Нейтральный рН равен 7, что соответствует рН воды. В норме pH крови находится в пределах от 7,35 до 7,45. pH крови менее 7,35 считается кислой, а pH крови более 7,45 считается щелочной.
рН крови является мерой концентрации ионов водорода. Низкий рН, менее 7,35, возникает при ацидозе, когда в крови высокая концентрация ионов водорода. Высокий рН, более 7,45, возникает при алкалозе, когда в крови низкая концентрация ионов водорода. Ионы водорода являются побочными продуктами метаболизма таких веществ, как белки, жиры и углеводы. Эти побочные продукты создают дополнительные ионы водорода (H+) в крови, которые необходимо сбалансировать и поддерживать в нормальном диапазоне, как описано ранее.
В организме есть несколько механизмов поддержания рН крови.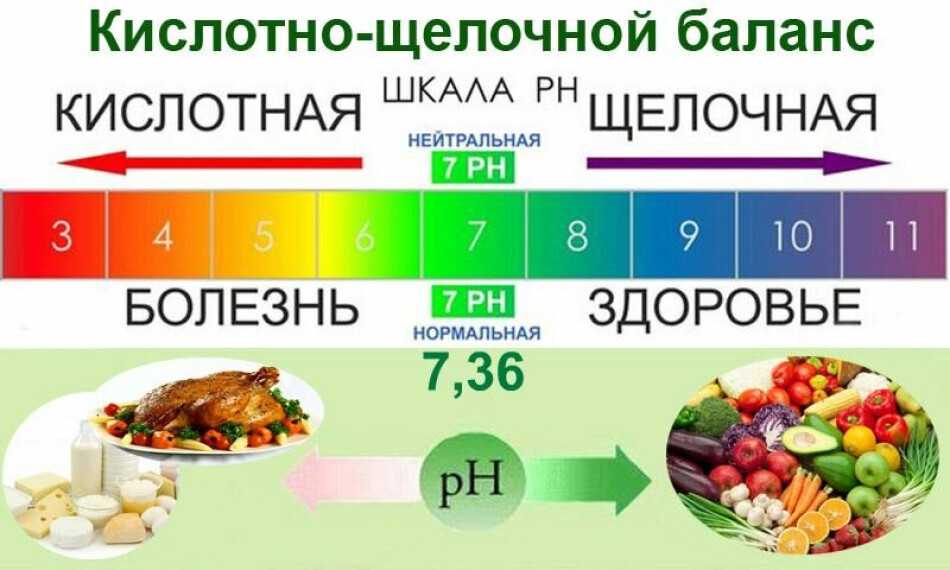 Легкие необходимы для поддержания рН, и почки также играют определенную роль. Например, при слишком низком уровне pH (т. е. при ацидозе) частота дыхания быстро увеличивается, что приводит к выведению кислоты в виде двуокиси углерода (CO2). Почки выделяют дополнительные ионы водорода (кислоту) с мочой и удерживают бикарбонат (основание). Наоборот, когда рН слишком высок (например, при алкалозе), частота дыхания снижается, чтобы сохранить кислоту в форме СО2. Почки выделяют бикарбонат (основание) с мочой и удерживают ионы водорода (кислоту).
Легкие необходимы для поддержания рН, и почки также играют определенную роль. Например, при слишком низком уровне pH (т. е. при ацидозе) частота дыхания быстро увеличивается, что приводит к выведению кислоты в виде двуокиси углерода (CO2). Почки выделяют дополнительные ионы водорода (кислоту) с мочой и удерживают бикарбонат (основание). Наоборот, когда рН слишком высок (например, при алкалозе), частота дыхания снижается, чтобы сохранить кислоту в форме СО2. Почки выделяют бикарбонат (основание) с мочой и удерживают ионы водорода (кислоту).
ПаСО2
PaCO2 — парциальное давление углекислого газа в артериальной крови. Нормальный уровень PaCO2 составляет 35-45 мм рт.ст. CO2 образует кислоту в крови, которая регулируется легкими путем изменения частоты или глубины дыхания.
По мере того, как частота дыхания увеличивается или становится глубже, удаляется дополнительное количество CO2, вызывая снижение уровня кислоты (H+) в крови и повышение pH (поэтому кровь становится более щелочной). По мере того, как частота дыхания уменьшается или становится более поверхностной, удаляется меньше CO2, что приводит к повышению уровня кислоты (H+) в крови и снижению pH (поэтому кровь становится более кислой).
По мере того, как частота дыхания уменьшается или становится более поверхностной, удаляется меньше CO2, что приводит к повышению уровня кислоты (H+) в крови и снижению pH (поэтому кровь становится более кислой).
Как правило, легкие быстро регулируют уровень PaCO2 и вызывают быстрое изменение pH. Таким образом, кислотно-щелочное состояние, вызванное гиповентиляцией, можно быстро исправить, увеличив вентиляцию, а проблему, вызванную гипервентиляцией, можно быстро устранить, уменьшив вентиляцию. Например, если у тревожного пациента гипервентиляция, его могут попросить вдохнуть в бумажный пакет, чтобы повторно вдохнуть часть CO2, который он выдувает. И наоборот, послеоперационного пациента, который испытывает гиповентиляцию из-за седативного эффекта приема морфина, просят покашлять и глубоко вдохнуть, чтобы выпустить больше CO2.
HCO3
HCO3 — это уровень бикарбоната в крови, нормальный диапазон составляет 22-26. HCO3 — это основание, которое вырабатывается почками и помогает сделать кровь более щелочной. Почкам требуется больше времени, чем легким, чтобы отрегулировать кислотность или щелочность крови, и реакция не видна при оценке. Когда почки ощущают изменение pH, они начинают удерживать или выделять HCO3, в зависимости от того, что необходимо. Если pH становится кислым, почки удерживают HCO3, чтобы увеличить количество оснований, присутствующих в крови, для увеличения pH. И наоборот, если pH становится щелочным, почки выделяют больше HCO3, вызывая снижение pH.
Почкам требуется больше времени, чем легким, чтобы отрегулировать кислотность или щелочность крови, и реакция не видна при оценке. Когда почки ощущают изменение pH, они начинают удерживать или выделять HCO3, в зависимости от того, что необходимо. Если pH становится кислым, почки удерживают HCO3, чтобы увеличить количество оснований, присутствующих в крови, для увеличения pH. И наоборот, если pH становится щелочным, почки выделяют больше HCO3, вызывая снижение pH.
ПаО2
ПаО2 — парциальное давление артериального кислорода в крови. Он более точно измеряет состояние оксигенации пациента, чем SaO2 (измерение насыщения гемоглобина кислородом). Таким образом, результаты ABG также используются для лечения пациентов с респираторным дистресс-синдромом.
Подробнее об интерпретации результатов газового анализа читайте в главе «Кислородная терапия» в Open RN Навыки ухода за больными .
См. Таблицу 15.5a для обзора компонентов ABG, нормальных значений и ключевых критических значений.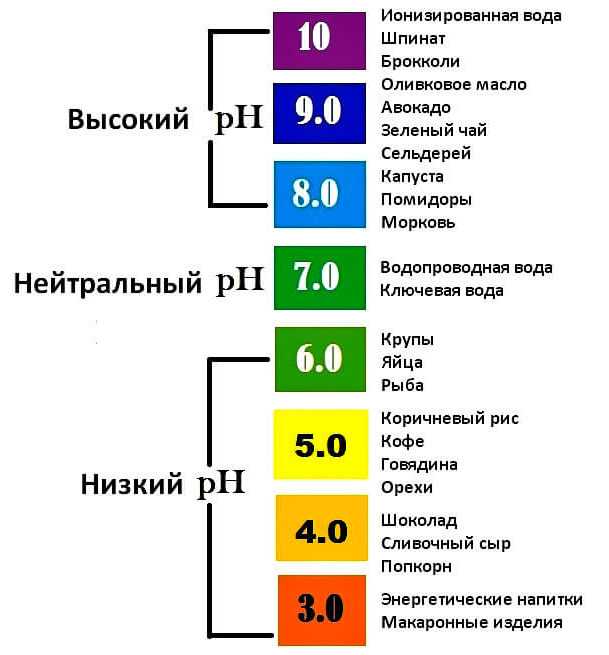 Критическое значение ABG означает, что существует более высокий риск серьезных осложнений и даже смерти, если не будет проведена быстрая коррекция. Например, рН 7,10, отклонение всего на 0,25 ниже нормы, часто приводит к летальному исходу, поскольку такой уровень ацидоза может вызвать остановку сердца или дыхания или значительную гиперкалиемию. [1] Как видите, неспособность распознать отклонения от нормы ABG может иметь серьезные последствия для ваших пациентов.
Критическое значение ABG означает, что существует более высокий риск серьезных осложнений и даже смерти, если не будет проведена быстрая коррекция. Например, рН 7,10, отклонение всего на 0,25 ниже нормы, часто приводит к летальному исходу, поскольку такой уровень ацидоза может вызвать остановку сердца или дыхания или значительную гиперкалиемию. [1] Как видите, неспособность распознать отклонения от нормы ABG может иметь серьезные последствия для ваших пациентов.
Таблица 15.5a Компоненты ABG, описания, нормальные значения для взрослых и критические значения [2]
| Компонент ABG | Описание | Нормальное значение для взрослых | Критическое значение |
|---|---|---|---|
| рН |
| 7,35-7,45 | <7,25 >7,60 |
| ПаО2 |
| 80-100 мм рт.ст. | <60 мм рт.ст. |
| ПаСО2 |
| 35-45 мм рт.ст. | <25 мм рт.ст. >60 мм рт.ст. |
| HCO3 |
| 22-26 мэкв/л | <10 мэкв/л >40 мэкв/л |
| SaO2 |
| 95-100% | <88% |
Видеообзор кислотно-щелочного баланса
[3]
Интерпретация газов артериальной крови
После получения результатов ABG важно понять, как их интерпретировать. Разнообразные проблемы с дыханием, обменом веществ, электролитами или кровообращением могут вызывать кислотно-щелочной дисбаланс. Правильная интерпретация также помогает медсестре и другим медицинским работникам определить подходящее лечение и оценить эффективность вмешательств.
Газы артериальной крови можно интерпретировать как одно из четырех состояний: респираторный ацидоз, респираторный алкалоз, метаболический ацидоз или метаболический алкалоз. После того, как эта интерпретация сделана, условия могут быть дополнительно классифицированы как компенсированные, частично компенсированные или некомпенсированные. Простой способ запомнить, как интерпретировать ABG, — это использовать метод интерпретации ROME, что означает 9.0056 R Респираторный O Ппозитный, M Этаболический E Качественный. Это означает, что дыхательный компонент (PaCO2) движется в направлении, противоположном pH, если дыхательная система вызывает дисбаланс. Если метаболическая система вызывает дисбаланс, метаболический компонент (HCO3) движется в том же направлении, что и pH. Некоторые медсестры считают полезным метод интерпретации крестиков-ноликов. Если вы хотите узнать больше об этом методе, нажмите на гиперссылку ниже, чтобы просмотреть видео.
Обзор метода крестиков-ноликов интерпретации ABG
[4]
Респираторный ацидоз
Респираторный ацидоз развивается, когда в организме накапливается углекислый газ (CO2) (обозначаемый как ), в результате чего кровь становится все более кислой. Респираторный ацидоз определяется при анализе газов крови, а уровень pH ниже 7,35 и уровень PaCO2 выше 45, что указывает на респираторную причину ацидоза. Обратите внимание, что при респираторном ацидозе по мере увеличения уровня PaCO2 уровень pH снижается. Респираторный ацидоз обычно вызывается заболеванием, которое снижает обмен кислорода и углекислого газа на альвеолярном уровне, например обострением астмы, хронической обструктивной болезнью легких (ХОБЛ) или обострением острой сердечной недостаточности, вызывающим отек легких. Это также может быть вызвано снижением вентиляции из-за анестезии, алкоголя или приема лекарств, таких как опиоиды и седативные средства.
Это также может быть вызвано снижением вентиляции из-за анестезии, алкоголя или приема лекарств, таких как опиоиды и седативные средства.
Хронические респираторные заболевания, такие как ХОБЛ, часто вызывают хронический респираторный ацидоз, который полностью компенсируется почками, удерживающими HCO3. Поскольку уровень углекислого газа со временем увеличивается, организм приспосабливается к повышенным уровням PaCO2, поэтому они лучше переносятся. Однако при остром респираторном ацидозе организм не успевает адаптироваться к повышенному уровню углекислого газа, вызывая изменения психического статуса, связанные с гиперкапнией. Острый респираторный ацидоз вызывается острыми респираторными заболеваниями, такими как приступ астмы или обострение сердечной недостаточности с отеком легких, когда легкие внезапно теряют способность адекватно вентилировать. По мере того как дыхание замедляется и дыхание становится поверхностным, легкие выделяют меньше CO2, и уровень PaCO2 быстро повышается.
Признаки симптомов гиперкапнии варьируют в зависимости от уровня и скорости накопления СО2 в артериальной крови:
- Пациенты с легкой и умеренной гиперкапнией могут испытывать тревогу и/или жаловаться на легкую одышку, дневную вялость, головные боли или повышенную сонливость.
- У пациентов с более высоким уровнем СО2 или быстро развивающейся гиперкапнией развиваются делирий, паранойя, депрессия и спутанность сознания, которые могут прогрессировать до судорог и комы по мере дальнейшего повышения уровня.
У людей с нормальной функцией легких обычно наблюдается снижение уровня сознания, когда PaCO2 превышает 75–80 мм рт. [5]
Когда у пациента проявляются признаки потенциальной гиперкапнии, медсестра должна оценить проходимость дыхательных путей, дыхание и кровообращение. Следует обратиться за неотложной помощью, особенно если у пациента дыхательная недостаточность. Поставщик закажет анализ газов крови и назначит лечение на основе результатов оценки и возможных причин. Лечение респираторного ацидоза обычно включает улучшение вентиляции и дыхания путем устранения ограничений проходимости дыхательных путей, устранение чрезмерной седации, применение небулайзерной терапии или увеличение частоты и глубины дыхания с помощью устройств BiPAP или CPAP. Устройства BiPAP и CPAP обеспечивают неинвазивную вентиляцию с положительным давлением для увеличения глубины дыхания, удаления углекислого газа и насыщения пациента кислородом. Если эти неинвазивные вмешательства не увенчались успехом, пациента интубируют и переводят на искусственную вентиляцию легких. [6] , [7]
Лечение респираторного ацидоза обычно включает улучшение вентиляции и дыхания путем устранения ограничений проходимости дыхательных путей, устранение чрезмерной седации, применение небулайзерной терапии или увеличение частоты и глубины дыхания с помощью устройств BiPAP или CPAP. Устройства BiPAP и CPAP обеспечивают неинвазивную вентиляцию с положительным давлением для увеличения глубины дыхания, удаления углекислого газа и насыщения пациента кислородом. Если эти неинвазивные вмешательства не увенчались успехом, пациента интубируют и переводят на искусственную вентиляцию легких. [6] , [7]
Подробнее об оборудовании для оксигенации читайте в разделе «Кислородная терапия» в Open RN Навыки ухода за больными .
Респираторный алкалоз
Респираторный алкалоз развивается, когда организм удаляет слишком много углекислого газа с дыханием, что приводит к повышению pH и алкалическому состоянию. При просмотре ABG респираторный алкалоз определяется, когда уровень pH выше 7,45, а уровень PaCO2 ниже 35. При респираторном алкалозе обратите внимание, что по мере снижения уровня PaCO2 уровень pH увеличивается.
При респираторном алкалозе обратите внимание, что по мере снижения уровня PaCO2 уровень pH увеличивается.
Респираторный алкалоз вызывается гипервентиляцией, которая может возникнуть из-за беспокойства, панических атак, боли, страха, травм головы или искусственной вентиляции легких. Передозировка салицилатов и других токсинов также может вначале вызывать респираторный алкалоз, а затем часто прогрессировать до метаболического ацидоза на более поздних стадиях. Обострения астмы, легочная эмболия или другие респираторные заболевания могут первоначально вызвать респираторный алкалоз, поскольку легкие учащают дыхание в попытке увеличить оксигенацию, что снижает PaCO2. Однако через некоторое время эти гипоксические расстройства вызывают респираторный ацидоз, поскольку дыхательные мышцы утомляются, дыхание замедляется, а в крови накапливается СО2.
Пациенты с респираторным алкалозом часто жалуются на одышку, головокружение или предобморочное состояние, боль или стеснение в груди, парестезии и сердцебиение в результате снижения уровня углекислого газа. [8] Респираторный алкалоз не является смертельным, но важно понимать, что основные состояния, такие как обострение астмы или легочная эмболия, могут быть опасными для жизни, поэтому лечение этих основных состояний имеет важное значение. По мере увеличения уровня pH почки будут пытаться компенсировать нехватку ионов H+ путем реабсорбции HCO3 до того, как он будет выведен с мочой. Это медленный процесс, поэтому может потребоваться дополнительное лечение.
[8] Респираторный алкалоз не является смертельным, но важно понимать, что основные состояния, такие как обострение астмы или легочная эмболия, могут быть опасными для жизни, поэтому лечение этих основных состояний имеет важное значение. По мере увеличения уровня pH почки будут пытаться компенсировать нехватку ионов H+ путем реабсорбции HCO3 до того, как он будет выведен с мочой. Это медленный процесс, поэтому может потребоваться дополнительное лечение.
Лечение респираторного алкалоза включает устранение основной причины гипервентиляции. Неотложная помощь пациентам с гипервентиляцией должна быть сосредоточена на успокоении пациента, объяснении симптомов, которые испытывает пациент, устранении любых стрессоров и начале перетренировки дыхания. Дыхательная переподготовка пытается сосредоточить пациента на брюшном (диафрагмальном) дыхании. Узнайте больше о переподготовке дыхания в следующей рамке.
Повторное обучение дыханию
Сидя или лежа на спине, пациент должен положить одну руку на живот, а другую на грудь, а затем попросить посмотреть, какая рука движется с большей экскурсией. У пациентов с гипервентиляцией это почти всегда будет рука на груди. Попросите пациента отрегулировать дыхание так, чтобы рука на животе двигалась с большей экскурсией, а рука на груди вообще почти не двигалась. Убедите пациента, что этому трудно научиться и что для полного овладения им потребуется некоторая практика. Попросите пациента медленно вдохнуть в течение четырех секунд, сделать паузу на несколько секунд, а затем выдохнуть в течение восьми секунд. После 5-10 таких дыхательных циклов больной должен начать ощущать чувство спокойствия с уменьшением беспокойства и улучшением гипервентиляции. В идеале симптомы должны исчезнуть при продолжении этого дыхательного упражнения.
У пациентов с гипервентиляцией это почти всегда будет рука на груди. Попросите пациента отрегулировать дыхание так, чтобы рука на животе двигалась с большей экскурсией, а рука на груди вообще почти не двигалась. Убедите пациента, что этому трудно научиться и что для полного овладения им потребуется некоторая практика. Попросите пациента медленно вдохнуть в течение четырех секунд, сделать паузу на несколько секунд, а затем выдохнуть в течение восьми секунд. После 5-10 таких дыхательных циклов больной должен начать ощущать чувство спокойствия с уменьшением беспокойства и улучшением гипервентиляции. В идеале симптомы должны исчезнуть при продолжении этого дыхательного упражнения.
Если метод восстановления дыхания не помогает купировать эпизод гипервентиляции, а тяжелые симптомы сохраняются, пациенту может быть назначена небольшая доза бензодиазепина короткого действия (например, лоразепам 0,5–1 мг перорально или 0,5–1 мг внутривенно). Текущие исследования показывают, что указание пациентам с гипервентиляцией повторно вдыхать углекислый газ (CO2) путем вдыхания в бумажный пакет может вызвать значительную гипоксемию со значительными осложнениями, поэтому это вмешательство больше не рекомендуется. При повторном дыхании необходимо постоянно контролировать уровень насыщения кислородом. [9]
При повторном дыхании необходимо постоянно контролировать уровень насыщения кислородом. [9]
Метаболический ацидоз
Метаболический ацидоз возникает при накоплении кислот (ионов водорода) и недостаточном количестве оснований (HCO3) в организме. В нормальных условиях почки выводят кислоты с мочой и нейтрализуют излишки кислот за счет увеличения реабсорбции бикарбоната (HCO3) из мочи для поддержания нормального pH. Когда почки не в состоянии выполнять эту буферную функцию до уровня, необходимого для выделения и нейтрализации избытка кислоты, возникает метаболический ацидоз.
Метаболический ацидоз характеризуется уровнем pH ниже 7,35 и уровнем HCO3 ниже 22 при рассмотрении ABG. Важно отметить, что и pH, и HCO3 снижаются при метаболическом ацидозе (т. е. pH и HCO3 движутся в одном и том же направлении вниз). Распространенной причиной метаболического ацидоза является диабетический кетоацидоз, при котором кислоты, называемые кетонами, накапливаются в крови при чрезвычайно высоком уровне сахара в крови. Другой частой причиной метаболического ацидоза у госпитализированных пациентов является лактоацидоз, который может быть вызван нарушением оксигенации тканей. Метаболический ацидоз также может быть вызван повышенной потерей бикарбоната из-за тяжелой диареи или почечной недостаточности, вызывающей снижение выведения кислоты. Кроме того, токсины, такие как избыток салицилата, могут вызывать метаболический ацидоз. [10]
Другой частой причиной метаболического ацидоза у госпитализированных пациентов является лактоацидоз, который может быть вызван нарушением оксигенации тканей. Метаболический ацидоз также может быть вызван повышенной потерей бикарбоната из-за тяжелой диареи или почечной недостаточности, вызывающей снижение выведения кислоты. Кроме того, токсины, такие как избыток салицилата, могут вызывать метаболический ацидоз. [10]
Медсестры могут сначала заподозрить у пациента метаболический ацидоз из-за учащенного дыхания, которое возникает, когда легкие пытаются удалить избыток CO2 в попытке устранить ацидоз. Другие симптомы метаболического ацидоза включают спутанность сознания, снижение уровня сознания, гипотензию и нарушения электролитного баланса, которые могут прогрессировать до циркуляторного коллапса и смерти, если не принять своевременные меры. Важно быстро уведомить поставщика услуг о подозрении на метаболический ацидоз, чтобы можно было провести анализ газов крови и назначить лечение (в зависимости от причины метаболического ацидоза) для улучшения уровня кислотности. Лечение включает внутривенное введение жидкости для улучшения состояния гидратации, контроля уровня глюкозы и поддержки кровообращения. Когда рН падает ниже 7,1, часто назначают бикарбонат натрия внутривенно, чтобы помочь нейтрализовать кислоты в крови. [11] , [12]
Лечение включает внутривенное введение жидкости для улучшения состояния гидратации, контроля уровня глюкозы и поддержки кровообращения. Когда рН падает ниже 7,1, часто назначают бикарбонат натрия внутривенно, чтобы помочь нейтрализовать кислоты в крови. [11] , [12]
Метаболический алкалоз
Метаболический алкалоз возникает, когда в организме слишком много бикарбоната (HCO3) или чрезмерная потеря кислоты (ионов H+). Метаболический алкалоз определяется pH выше 7,45 и уровнем HCO3 выше 26 по результатам ABG. Обратите внимание, что и pH, и HCO3 повышены при метаболическом алкалозе.
Метаболический алкалоз может быть вызван желудочно-кишечной потерей ионов водорода, чрезмерной потерей мочи, чрезмерным уровнем бикарбоната или перемещением ионов водорода из кровотока в клетки.
Продолжительная рвота или назогастральное отсасывание также могут вызывать метаболический алкалоз. Желудочный секрет имеет высокий уровень ионов водорода (H+), поэтому при потере кислоты уровень pH в кровотоке повышается.
Чрезмерная потеря мочи (из-за диуретиков или чрезмерного количества минералокортикоидов) может вызвать метаболический алкалоз из-за потери ионов водорода с мочой. Внутривенное введение бикарбоната натрия также может вызвать метаболический алкалоз из-за повышенного уровня введенных в организм оснований. Хотя когда-то считалось, что чрезмерное потребление антацидов кальция может вызвать метаболический алкалоз, было обнаружено, что это происходит только в том случае, если они применяются одновременно с Кайекселатом. [13]
Ионы водорода могут перемещаться в клетки из-за гипокалиемии, вызывая метаболический алкалоз. Когда возникает гипокалиемия (то есть низкий уровень калия в кровотоке), калий перемещается из клеток в кровоток, пытаясь поддерживать нормальный уровень калия в сыворотке для оптимальной сердечной функции. Однако по мере того, как молекулы калия (K+) выходят из клеток, ионы водорода (H+) затем перемещаются в клетки из кровотока для поддержания электрической нейтральности. Этот перенос ионов приводит к падению pH в кровотоке, вызывая метаболический алкалоз. [14]
Этот перенос ионов приводит к падению pH в кровотоке, вызывая метаболический алкалоз. [14]
Медсестра может сначала заподозрить у пациента метаболический алкалоз из-за снижения частоты дыхания (поскольку легкие пытаются удерживать дополнительный СО2 для повышения кислотности крови и устранения алкалоза). Пациент также может быть сбит с толку из-за измененного уровня рН. Медсестра должна сообщить о признаках подозрения на метаболический алкалоз, поскольку нескорректированный метаболический алкалоз может привести к гипотензии и сердечной дисфункции. [15]
Лечение назначается на основании результатов анализа газов крови и предполагаемой причины. Например, устраните причину рвоты, прекратите аспирацию желудочно-кишечного тракта или прекратите прием диуретиков. При наличии гипокалиемии ее следует лечить. Если вводят бикарбонат, его следует прекратить. Пациентам с заболеванием почек может потребоваться диализ. [16]
Анализ результатов ABG
Теперь, когда мы обсудили различия между различными кислотно-щелочными дисбалансами, давайте рассмотрим шаги для систематической интерпретации результатов ABG. В табл. 15.5b показаны этапы интерпретации ABG.
В табл. 15.5b показаны этапы интерпретации ABG.
Таблица 15.5b Анализ результатов ABG [17] , [18]
| Шаг | Действие |
|---|---|
| Этап 1: рН (нормальный 7,35-7,45) | Если рН выходит за пределы диапазона, определите, является ли это ацидозом или алкалозом:
|
| Этап 2: PaCO2 (норма 35-45 мм рт.ст.) |
**Если дисбаланс не вызван респираторной проблемой, перейдите к оценке HCO3. |
| Этап 3: HCO3 (нормальный 22-26) |
|
| Шаг 4: Определение уровня компенсации | После определения причины дисбаланса pH определите, имеет ли место компенсация.
|
- Митчел, Дж. Х., Вильденталь, К., и Джонсон-младший, Р. Л. (1972). Влияние кислотно-основных нарушений на сердечно-сосудистую и легочную функции. Kidney International, 1 , 375-389. https://www.kidney-international.org/article/S0085-2538(15)31047-4/pdf ↵
- WakeMed Pathology Laboratories. (2016). Критические значения . https://www.wakemed.org/assets/documents/pathology/lab-critical-values.pdf ↵
- Forciea, B. (2017, 10 мая). Кислотно-щелочной баланс: Бикарбонат-ионный буфер . [Видео]. YouTube. Все права защищены. Видео использовано с разрешения. https://youtu.be/5_S5wZks9v8 ↵
- RegisteredNurseRN. (2015, 6 мая). ABG упрощается для медсестер с помощью метода «крестики-нолики» для интерпретации газов артериальной крови .
 [Видео]. YouTube. Все права защищены. Видео использовано с разрешения. https://youtu.be/URCS4t9aM5o ↵
[Видео]. YouTube. Все права защищены. Видео использовано с разрешения. https://youtu.be/URCS4t9aM5o ↵ - Феллер-Копман, Д. Дж., и Шварцштейн, Р. М. (2020). Обследование, диагностика и лечение взрослого пациента с острой гиперкапнической дыхательной недостаточностью. Обновление . https://www.uptodate.com/contents/the-evaluation-diagnosis-and-treatment-of-the-adult-patient-with-acute-hypercapnic-respiratory-failure ↵
- A.D.A.M. Медицинская энциклопедия [Интернет]. Атланта (Джорджия): ADAM, Inc.; с1997-2021. респираторный ацидоз; [обновлено 8 февраля 2021 г.]. https://medlineplus.gov/ency/article/000092.htm ↵
- Феллер-Копман, Д. Дж., и Шварцштейн, Р. М. (2020). Обследование, диагностика и лечение взрослого пациента с острой гиперкапнической дыхательной недостаточностью. Обновление . https://www.uptodate.com/contents/the-evaluation-diagnosis-and-treatment-of-the-adult-patient-with-acute-hypercapnic-respiratory-failure ↵
- Schwartzstein, R.
 M., Richards, J. , Эдлоу, Дж. А., и Рой-Бирн, П. П. (2020). Синдром гипервентиляции у взрослых. Обновление . https://www.uptodate.com/contents/hyperventilation-syndrome-in-adults ↵
M., Richards, J. , Эдлоу, Дж. А., и Рой-Бирн, П. П. (2020). Синдром гипервентиляции у взрослых. Обновление . https://www.uptodate.com/contents/hyperventilation-syndrome-in-adults ↵ - Шварцштейн, Р. М., Ричардс, Дж., Эдлоу, Дж. А., и Рой-Бирн, П. П. (2020). Синдром гипервентиляции у взрослых. Обновление . https://www.uptodate.com/contents/hyperventilation-syndrome-in-adults ↵
- Emmett, M., & Szerlip, H. (2020). Подход к взрослому с метаболическим ацидозом. Обновление . https://www.uptodate.com/contents/approach-to-the-adult-with-metabolic-acidosis ↵
- А.Д.А.М. Медицинская энциклопедия [Интернет]. Атланта (Джорджия): ADAM, Inc.; c1997-2021. Метаболический ацидоз; [обновлено 8 февраля 2021 г.]. https://medlineplus.gov/ency/article/000335.htm ↵
- Emmett, M., & Szerlip, H. (2020). Подход к взрослому с метаболическим ацидозом. Обновление . https://www.uptodate.com/contents/approach-to-the-adult-with-metabolic-acidosis ↵
- Emmett, M.
 , & Szerlip, H. (2020). Причины метаболического алкалоза. Обновление . https://www.uptodate.com/contents/causes-of-metabolic-alkalosis ↵
, & Szerlip, H. (2020). Причины метаболического алкалоза. Обновление . https://www.uptodate.com/contents/causes-of-metabolic-alkalosis ↵ - Эммет, М., и Шерлип, Х. (2020). Причины метаболического алкалоза. Обновление . https://www.uptodate.com/contents/causes-of-metabolic-alkalosis ↵
- Эта работа является производной от StatPearls Бринкмана и Шармы и распространяется по лицензии CC BY 4.0 ↵
- Emmett, M., & Szerlip , Х. (2020). Причины метаболического алкалоза. Обновление . https://www.uptodate.com/contents/causes-of-metabolic-alkalosis ↵
- Эта работа является производной от StatPearls Кастро и Кинагана и распространяется под лицензией CC BY 4.0 ↵
- Вудрафф, Д. В. (2012). 6 простых шагов к анализу ABG . Ed4Nurses, Inc. http://www.profcaseyscudmorern.org/uploads/4/5/0/4/45049193/abgebook.pdf ↵
Как использовать таблицу pKa — Наставник по органической химии
youtube.com/embed/cheh-JCxpuM?feature=oembed&controls=0&autoplay=0&modestbranding=1&showinfo=0&rel=0&enablejsapi=1″ frameborder=»0″ allow=»accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»>
В этом уроке Я хочу поговорить об основах кислотно-щелочного равновесия и о том, как мы его используем в рамках органической химии. Но прежде чем мы углубимся в детали самого кислотно-щелочного равновесия, давайте рассмотрим, что такое основание и что такое кислота согласно различным определениям. Существует три наиболее распространенных определения кислот и оснований, и самое простое, пожалуй, определение Аррениуса.
Кислоты и основания Аррениуса
Согласно определению Аррениуса, предложенному шведским физико-химиком Сванте Аррениусом, кислота является донором протона (H + ), а основание является донором гидроксильного иона (OH – ). Типичным примером кислоты Аррениуса является что-то вроде соляной кислоты (HCl). В то время как типичным примером основания Аррениуса является что-то вроде гидроксида натрия (NaOH). Как только эти частицы диссоциируют, HCl дает H + в раствор, в то время как NaOH выделяет OH – ион.
В то время как типичным примером основания Аррениуса является что-то вроде гидроксида натрия (NaOH). Как только эти частицы диссоциируют, HCl дает H + в раствор, в то время как NaOH выделяет OH – ион.
Проблема с этим определением заключается в том, что оно чрезвычайно ограничено по своему охвату и применимо только к водным растворам. Однако в органической химии мы редко имеем дело с водными растворами. Таким образом, это определение не подходит для наших целей.
Кислоты и основания Бренстеда-Лоури
Датский физико-химик Йоханнес Бренстед и английский физико-химик Томас Лоури предложили более общее определение кислотно-основного вещества. Согласно теории Бренстеда-Лоури, кислота является донором H + , а основанием является акцептор H + . Таким образом, теория может быть расширена на кислоты и основания в любых средах и не ограничивается только водными растворами.
Таким образом, кислота Бренстеда относится к тому же виду, что и кислота Аррениуса. Однако, когда дело доходит до основания, основанием является только тот вид, который принимает протон. Так, в гидроксиде натрия (NaOH) основанием является только ОН – , а не вся молекула. Это очень распространенная ошибка, поэтому на экзамене вы можете ожидать обмана с этим определением.
Однако, когда дело доходит до основания, основанием является только тот вид, который принимает протон. Так, в гидроксиде натрия (NaOH) основанием является только ОН – , а не вся молекула. Это очень распространенная ошибка, поэтому на экзамене вы можете ожидать обмана с этим определением.
Также помните, что если вид принял протон, то это основание, независимо от того, как мы привыкли думать об этом. Например, если мы возьмем уксусную кислоту и протонируем ее (добавим к ней протон), то в такой реакции уксусная кислота будет действовать как основание.
Сопряженные кислоты и основания
Теория Бренстеда-Лоури также описывает взаимосвязь между реагентами в кислотно-основной реакции и продуктами. продуктов кислотно-основной реакции называются конъюгирует . Возьмем, к примеру, реакцию между метилацетатом (сложным эфиром) и серной кислотой. В этой реакции сложный эфир действует как основание, принимая протон, а серная кислота действует как кислота Бренстеда, предоставляя указанный протон. Как только наш сложный эфир (который является основанием на стороне реагента) принимает протон, он становится сопряженной кислотой. Точно так же, как только серная кислота теряет протон, она становится сопряженным основанием.
Как только наш сложный эфир (который является основанием на стороне реагента) принимает протон, он становится сопряженной кислотой. Точно так же, как только серная кислота теряет протон, она становится сопряженным основанием.
Таким образом, когда кислота теряет протон, она становится сопряженным основанием . И как только основание принимает протон, оно становится сопряженной кислотой . Помните, что когда мы говорим о конъюгатах, мы всегда говорим о продуктах специфической кислотно-основной реакции. Сопряженное основание, которое мы получили в приведенной выше реакции (HSO 4 – ), может диссоциировать дальше и стать кислотой в другой реакции. Но в данном конкретном случае ион HSO 4 – является сопряженным основанием.
Кислоты и основания Льюиса
Есть еще одна, еще более общая, кислотно-основная теория, предложенная американским физико-химиком Гилбертом Льюисом. Его кислотно-основную теорию иногда называют электронной теорией кислот и оснований. Согласно теории Льюиса, кислота является акцептором электронной пары, а основание является донором электронной пары.
Согласно теории Льюиса, кислота является акцептором электронной пары, а основание является донором электронной пары.
Для целей этого урока я не буду вдаваться в подробности теории Льюиса и оставлю это для другого урока. Однако в оставшейся части этого обсуждения я сосредоточусь исключительно на теории кислот и оснований Бренстеда-Лоури.
Сильные кислоты против слабых кислот
Теперь, когда мы знаем, что такое кислоты и основания, давайте немного поговорим о качественной разнице между ними. А именно, я хочу посмотреть на разницу между сильными кислотами и слабыми кислотами.
Когда мы говорим, что кислота сильная, мы имеем в виду, что указанная кислота полностью диссоциирует в растворе. Точно так же, если кислота слабая, она только частично диссоциирует.
Что именно это означает? Давайте посмотрим на эти два примера:
Слева у меня бромистоводородная кислота (HBr), очень сильная кислота. А справа — уксусная кислота (CH 3 COOH), типичная слабая кислота. Когда сильная кислота диссоциирует полностью, это означает, что HBr практически не останется в растворе. А вот уксусная кислота, наоборот, при диссоциации не даст нам много продуктов диссоциации и преимущественно останется такой, какая она есть.
Когда сильная кислота диссоциирует полностью, это означает, что HBr практически не останется в растворе. А вот уксусная кислота, наоборот, при диссоциации не даст нам много продуктов диссоциации и преимущественно останется такой, какая она есть.
Как определить кислотность?
Сказать, что одна кислота сильная, а другая слабая, это немного махать руками. Итак, есть ли способ, как мы можем количественно определить «сильных» и «слабых», используя какое-то числовое значение?
Для этой цели мы используем константы кислотной диссоциации (значения K a ). По определению константа диссоциации кислоты равна отношению концентраций продуктов к концентрациям реагентов.
Рассмотрим это на примере диссоциации HCN:
Цианистый водород является слабой кислотой и лишь частично диссоциирует. Реагентом в данном случае является сама кислота (HCN). В то время как продуктами являются протон (H + ) и цианид-анион (CN – ). Теперь мы можем получить выражение для константы диссоциации, подставив концентрации этих частиц в уравнение для K a . А поскольку цианистый водород — слабая кислота, у нас будет очень небольшое количество нашей продукции. Это приводит к очень маленькому значению K и .
А поскольку цианистый водород — слабая кислота, у нас будет очень небольшое количество нашей продукции. Это приводит к очень маленькому значению K и .
Как читать значения K
и ?
Поскольку K a представляет собой математическое выражение состояния равновесия, его довольно легко интерпретировать. Если К значение небольшое, у нас не так много нашей продукции. Отсутствие продуктов означает отсутствие диссоциации. Отсутствие диссоциации означает слабую кислоту. Точно так же большое значение K и означает тонны продуктов. Тонны продуктов означают полную разобщенность. Полная диссоциация означает сильную кислоту. Довольно просто.
Проблема со значениями K и заключается в том, что это, как правило, очень уродливые числа, с которыми трудно работать, но в одиночку — помните. Поэтому, как правило, вместо этого мы собираемся использовать значения pKa. По определению, значение pKa представляет собой отрицательный логарифм K значение . Это не имеет никакого физического смысла, кроме удобства.
Это не имеет никакого физического смысла, кроме удобства.
Важной особенностью шкалы pKa является то, что она инвертирована по сравнению со шкалой K a . Таким образом, сильные кислоты будут иметь отрицательные значения pKa, а слабые кислоты будут иметь положительные значения pKa.
Примеры значений pKa и способы их использования
Давайте рассмотрим несколько видов, чтобы увидеть, как значения K a и значения pKa сравниваются друг с другом.
На этой картинке метанол, уксусная кислота, метантиол и метиламин. Рядом с каждым из этих видов у нас есть соответствующие K a и значения pKa. Проведя быстрое сравнение этих чисел, мы можем увидеть, что уксусная кислота является самой сильной кислотой среди этих молекул. Между тем, амин в самом конце представляет собой самую слабую кислоту с самым низким значением K a и, соответственно, самым высоким значением pKa. Таким образом, если бы мы захотели, например, ранжировать эти молекулы в соответствии с их кислотной силой от самой слабой до самой сильной, мы бы получили следующее: дополнительная практика, чтобы подготовиться к тесту.
Использование значений pKa для прогнозирования состояния равновесия
Теперь мы использовали значения K a и pKa для ранжирования силы кислоты. Что еще мы можем сделать с ними?
Ну, еще один типичный вопрос, который вы увидите в тесте, — это вопрос типа «предсказать состояние равновесия». У вас будет какая-то реакция, и вам нужно будет рассуждать со значениями pKa и выяснить, благоприятствует ли ваша реакция продуктам или реагентам.
Как бы вы ответили на такой вопрос? На самом деле это довольно простая проблема.
- Во-первых, вам нужно идентифицировать кислоту и сопряженную кислоту в вашей реакции.
- Затем найдите соответствующие значения pKa в таблице pKa.
- И, наконец, сравните эти значения. Равновесие всегда благоприятствует более слабой кислоте!
Посмотрите на эти два примера здесь:
В первом случае сопряженное основание имеет более низкое значение pKa, поэтому равновесие благоприятствует продуктам. Во втором примере кислота-реагент имеет более низкое значение pKa, что делает его более благоприятным видом, поэтому равновесие благоприятствует реагентам.
Во втором примере кислота-реагент имеет более низкое значение pKa, что делает его более благоприятным видом, поэтому равновесие благоприятствует реагентам.
Использование значений pKa для оценки Keq реакции
Наконец, мы можем использовать значения pKa для оценки константы равновесия самой реакции. По сути, это то же самое, что сказать, какую сторону реакции благоприятствует равновесие, но в количественном (также известном как числовой) способе.
Например, давайте посмотрим на эту реакцию:
Первое, что нам нужно сделать, это найти кислоту и сопряженную кислоту. Затем мы найдем значения pKa для них. Мы знаем, что кислота теряет протон в кислотно-щелочной реакции, поэтому очевидно, что ацетилен слева — это наша кислота. А начиная с NH 2 – принял, что протон, NH 3 является сопряженной кислотой.
Поиск этих значений в моей таблице pKa дает мне следующие числа:
Основываясь на нашем разговоре, состоявшемся несколько мгновений назад, мы уже знаем, что это равновесие благоприятствует продуктам, поскольку значение pKa для моей конъюгированной кислоты составляет 36 по сравнению с 25 для исходная кислота. Но насколько именно сдвинуто это равновесие?
Но насколько именно сдвинуто это равновесие?
Вот хитрость: мы можем легко оценить константу равновесия, взяв 10, возведенное в степень pKa для моей сопряженной кислоты, минус pKa исходной кислоты. Я не собираюсь утомлять вас подробностями того, как это получается. Я покажу точные детали в другом посте, или вы можете увидеть вывод в моих кислотно-щелочных заметках.
Этот расчет для этого конкретного примера дает 10 11 , что указывает на очень благоприятную реакцию. Таким образом, если раньше мы знали, что равновесие благоприятствует продуктам, то теперь мы знаем соотношение между продуктами и реагентами и оно равно 10 11 !
Вот еще пример:
В данном случае мы имеем исходную кислоту, которая намного слабее сопряженной кислоты. Итак, мы знаем, что равновесие будет смещено в сторону реагентов и реакция пойдет неблагоприятно. Однако, подставив значения в формулу, которую я показал вам минуту назад, мы можем увидеть, что константа равновесия здесь равна 10 -6,5 . А мы знаем, что малое значение константы равновесия связано с неблагоприятной реакцией.
А мы знаем, что малое значение константы равновесия связано с неблагоприятной реакцией.
Ознакомьтесь со своей таблицей pKa
В этом уроке мы довольно широко использовали значения pKa. Итак, я хочу подчеркнуть, насколько важно ознакомиться с таблицей pKa. Большинство инструкторов предоставят вам на экзамене своего рода таблицу pKa. Однако есть некоторые, которые заставят вас запомнить типичные значения и ничего не дадут. Убедитесь, что вы знаете, чего ожидать, и узнайте заранее, будет ли у вас таблица pKa на тесте!
Я предлагаю вам сделать копию таблицы, которую использует ваш преподаватель, и поместить ее под обложку вашего скоросшивателя по органической химии. Это сэкономит вам массу времени, когда вам нужно быстро найти значения pKa. И поверьте мне, в этом курсе вы будете довольно часто искать значения pKa!
Затем убедитесь, что вы умеете пользоваться своим столом. Некоторым инструкторам нравится использовать таблицу pKa с видами, расположенными в соответствии со значениями pKa. Лично я ненавижу их, потому что в них действительно сложно ориентироваться. Есть еще один вид, в котором таблица скомпонована по функциональным группам. Это, на мой взгляд, лучший вариант, так как в нем легко ориентироваться, зная, какое соединение и какие функциональные группы перед вами.
Лично я ненавижу их, потому что в них действительно сложно ориентироваться. Есть еще один вид, в котором таблица скомпонована по функциональным группам. Это, на мой взгляд, лучший вариант, так как в нем легко ориентироваться, зная, какое соединение и какие функциональные группы перед вами.
Наконец, я настоятельно рекомендую вам запомнить типичные значения pKa для наиболее распространенных функциональных групп. Хотя большинство инструкторов скажут вам, что не нужно ничего запоминать, это не совсем так. Да, вы, вероятно, будете иметь доступную для теста таблицу pKa. Но представьте, если бы вам приходилось перечитывать инструкцию к кофеварке каждое утро, когда вы хотели приготовить чашку вкусного кофе. Разве это не было бы ужасной тратой времени и неудобством (особенно если вы такой же сварливый по утрам, как и я, прежде чем я выпил свою первую чашку). Вы бы этого точно не хотели. То же самое и с таблицей pKa. Если вам придется тыкать в таблицу каждый раз, когда вы хотите перепроверить значение pKa для чего-то вроде карбоновой кислоты или спирта, вы потратите много драгоценного времени на тест.