НОВОСТИ |
Кальций и его характеристики. Из чего состоит кальцийкальций - это... Что такое кальций?КА́ЛЬЦИЙ -я; м. [от лат. calx (calcis) - известь] Химический элемент (Ca), металл серебристо-белого цвета, входящий в состав известняков, мрамора и др. ◁ Ка́льциевый, -ая, -ое. К-ые соли. КА́ЛЬЦИЙ (лат. Calcium), Ca (читается «кальций»), химический элемент с атомным номером 20, расположен в четвертом периоде в группе IIА периодической системы элементов Менделеева; атомная масса 40,08. Относится к числу щелочноземельных элементов (см. ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ). Природный кальций состоит из смеси нуклидов (см. НУКЛИД) с массовыми числами 40 (в смеси по массе 96,94 %), 44 (2,09%), 42 (0,667%), 48 (0,187%), 43 (0,135%) и 46 (0,003%). Конфигурация внешнего электронного слоя 4s2. Практически во всех соединениях степень окисления кальция +2 (валентность II). Радиус нейтрального атома кальция 0,1974 нм, радиус иона Cа2+ от 0,114 нм (для координационного числа 6) до 0,148 нм (для координационного числа 12). Энергии последовательной ионизации нейтрального атома кальция равны, соответственно, 6,133, 11,872, 50,91, 67,27 и 84,5 эВ. По шкале Полинга электроотрицательность кальция около 1,0. В свободном виде кальций — серебристо-белый металл. История открытия Соединения кальция встречаются в природе повсеместно, поэтому человечество знакомо с ними с древнейших времен. Издавна в строительном деле находила применение известь (см. ИЗВЕСТЬ) (негашеная и гашеная), которую долгое время считали простым веществом, «землей». Однако в 1808 английский ученый Г. Дэви (см. ДЭВИ Гемфри) сумел получить из извести новый металл. Для этого Дэви подверг электролизу смесь слегка увлажненной гашеной извести с окисью ртути и выделил из образующейся на ртутном катоде амальгамы новый металл, который он назвал кальцием (от лат. calx, род. падеж calcis — известь). В России некоторое время этот металл называли «известковием». Нахождение в природе Кальций — один из наиболее распространенных на Земле элементов. На его долю приходится 3,38% массы земной коры (5-е место по распространенности после кислорода, кремния, алюминия и железа). Из-за высокой химической активности кальций в свободном виде в природе не встречается. Большая часть кальция содержится в составе силикатов (см. СИЛИКАТЫ) и алюмосиликатов (см. АЛЮМОСИЛИКАТЫ) различных горных пород (граниты (см. ГРАНИТ), гнейсы (см. ГНЕЙС) и т. п.). В виде осадочных пород соединения кальция представлены мелом и известняками, состоящими в основном из минерала кальцита (см. КАЛЬЦИТ) (CaCO3). Кристаллическая форма кальцита — мрамор — встречается в природе гораздо реже. Довольно широко распространены такие минералы кальция, как известняк (см. ИЗВЕСТНЯК) СaCO3, ангидрит (см. АНГИДРИТ) CaSO4 и гипс (см. ГИПС) CaSO4·2h3O, флюорит (см. ФЛЮОРИТ) CaF2, апатиты (см. АПАТИТЫ) Ca5(PO4)3(F,Cl,OH), доломит (см. ДОЛОМИТ) MgCO3·СaCO3. Присутствием солей кальция и магния в природной воде определяется ее жесткость (см. ЖЕСТКОСТЬ ВОДЫ). Значительное количество кальция входит в состав живых организмов. Так, гидроксилапатит Ca5(PO4)3(OH), или, в другой записи, 3Ca3(PO4)2 ·Са(OH)2 — основа костной ткани позвоночных, в том числе и человека; из карбоната кальция CaCO3 состоят раковины и панцири многих беспозвоночных, яичная скорлупа и др. Получение Металлический кальций получают электролизом расплава, состоящего из CaCl2 (75—80%) и KCl или из CaCl2 и CaF2, а также алюминотермическим восстановлением CaO при 1170—1200 °C: 4CaO + 2Al = CaAl2O4 + 3Ca. Физические и химические свойства Металл кальций существует в двух аллотропных модификациях (см. Аллотропия (см. АЛЛОТРОПИЯ)). До 443 °C устойчив a-Ca с кубической гранецентрированной решеткой (параметр а = 0,558 нм), выше устойчив b-Ca с кубической объемно центрированной решеткой типа a-Fe (параметр a = 0,448 нм). Температура плавления кальция 839 °C, температура кипения 1484 °C, плотность 1,55 г/см3. Химическая активность кальция высока, но ниже, чем всех других щелочноземельных металлов. Он легко взаимодействует с кислородом, углекислым газом и влагой воздуха, из-за чего поверхность металлического кальция обычно тускло серая, поэтому в лаборатории кальций обычно хранят, как и другие щелочноземельные металлы, в плотно закрытой банке под слоем керосина. В ряду стандартных потенциалов кальций расположен слева от водорода. Стандартный электродный потенциал пары Ca2+/Ca0 –2,84 В, так что кальций активно реагирует с водой: Ca + 2Н2О = Ca(ОН)2 + Н2. С активными неметаллами (кислородом, хлором, бромом) кальций реагирует при обычных условиях: 2Са + О2= 2СаО; Са + Br2= CaBr2. При нагревании на воздухе или в кислороде кальций воспламеняется. С менее активными неметаллами (водородом, бором, углеродом, кремнием, азотом, фосфором и другими) кальций вступает во взаимодействие при нагревании, например: Са + Н2= СаН2 (гидрид кальция), Ca + 6B = CaB6 (борид кальция), 3Ca + N2= Ca3N2 (нитрид кальция) Са + 2С = СаС2 (карбид кальция) 3Са + 2Р = Са3Р2 (фосфид кальция), известны также фосфиды кальция составов СаР и СаР5; 2Ca + Si = Ca2Si (силицид кальция), известны также силициды кальция составов CaSi, Ca3Si4 и CaSi2. Протекание указанных выше реакций, как правило, сопровождается выделением большого количества теплоты (т. е. эти реакции — экзотермические). Во всех соединениях с неметаллами степень окисления кальция +2. Большинство из соединений кальция с неметаллами легко разлагается водой, например: СаН2 + 2Н2О = Са(ОН)2 + 2Н2, Ca3N2 + 3Н2О = 3Са(ОН)2 + 2NН3. Оксид кальция — типично основной. В лаборатории и технике его получают термическим разложением карбонатов: CaCO3 = CaO + CO2. Технический оксид кальция СаО называется негашеной известью. Он реагирует с водой с образованием Ca(ОН)2 и выделением большого количества теплоты: CaО + Н2О = Ca(ОН)2. Полученный таким способом Ca(ОН)2 обычно называют гашеной известью или известковым молоком (см. ИЗВЕСТКОВОЕ МОЛОКО) из-за того, что растворимость гидроксида кальция в воде невелика (0,02 моль/л при 20°C), и при внесении его в воду образуется белая суспензия. При взаимодействии с кислотными оксидами CaO образует соли, например: CaО +СО2 = СаСО3; СаО + SO3 = CaSO4. Ион Ca2+ бесцветен. При внесении в пламя солей кальция пламя окрашивается в кирпично-красный цвет. Такие соли кальция, как хлорид CaCl2, бромид CaBr2, иодид CaI2 и нитрат Ca(NO3)2, хорошо растворимы в воде. Нерастворимы в воде фторид CaF2, карбонат CaCO3, сульфат CaSO4, средний ортофосфат Ca3(PO4)2, оксалат СаС2О4 и некоторые другие. Важное значение имеет то обстоятельство, что в отличие от среднего карбоната кальция СаСО3 кислый карбонат кальция (гидрокарбонат) Са(НСО3)2 в воде растворим. В природе это приводит к следующим процессам. Когда холодная дождевая или речная вода, насыщенная углекислым газом, проникает под землю и попадает на известняки, то наблюдается их растворение: СаСО3 + СО2+ Н2О = Са(НСО3)2. В тех же местах, где вода, насыщенная гидрокарбонатом кальция, выходит на поверхность земли и нагревается солнечными лучами, протекает обратная реакция: Са(НСО3)2 = СаСО3 + СО2+ Н2О. Так в природе происходит перенос больших масс веществ. В результате под землей могут образоваться огромные провалы (см. Карст (см. КАРСТ (явление природы))), а в пещерах образуются красивые каменные «сосульки» — сталактиты (см. СТАЛАКТИТЫ (минеральные образования)) и сталагмиты (см. СТАЛАГМИТЫ). Наличие в воде растворенного гидрокарбоната кальция во многом определяет временную жесткость воды (см. ЖЕСТКОСТЬ ВОДЫ). Временной ее называют потому, что при кипячении воды гидрокарбонат разлагается, и в осадок выпадает СаСО3. Это явление приводит, например, к тому, что в чайнике со временем образуется накипь. Применение кальция и его соединений Металлический кальций применяют для металлотермического получения урана (см. УРАН (химический элемент)), тория (см. ТОРИЙ), титана (см. ТИТАН (химический элемент)), циркония (см. ЦИРКОНИЙ), цезия (см. ЦЕЗИЙ) и рубидия (см. РУБИДИЙ). Природные соединения кальция широко используют в производстве вяжущих материалов (цемент (см. ЦЕМЕНТ), гипс (см. ГИПС), известь и др.). Связывающее действие гашеной извести основано на том, что с течением времени гидроксид кальция реагирует с углекислым газом воздуха. В результате протекающей реакции образуются игольчатые кристаллы кальцита СаСОз, которые прорастают в расположенные рядом камни, кирпичи, другие строительные материалы и как бы сваривают их в единое целое. Кристаллический карбонат кальция — мрамор — прекрасный отделочный материал. Мел используют для побелки. Большие количества известняка расходуются при производстве чугуна, так как позволяют перевести тугоплавкие примеси железной руды (например, кварц SiO2) в сравнительно легкоплавкие шлаки. В качестве дезинфицирующего средства очень эффективна хлорная известь (см. ХЛОРНАЯ ИЗВЕСТЬ) — «хлорка» Ca(OCl)Cl — смешанный хлорид и гипохлорид кальция (см. КАЛЬЦИЯ ГИПОХЛОРИТ), обладающий высокой окислительной способностью. Широко применяется и сульфат кальция, существующий как в виде безводного соединения, так и в виде кристаллогидратов — так называемого «полуводного» сульфата — алебастра (см. АЛЕВИЗ ФРЯЗИН (Миланец)) CaSO4·0,5h3O и двухводного сульфата — гипса CaSO4·2h3O. Гипс широко используют в строительстве, в скульптуре, для изготовления лепнины и различных художественных изделий. Применяют гипс и в медицине для фиксации костей при переломах. Хлорид кальция CaCl2 используют наряду с поваренной солью для борьбы с оледенением дорожных покрытий. Фторид кальция СаF2 — прекрасный оптический материал. Кальций в организме Кальций — биогенный элемент (см. БИОГЕННЫЕ ЭЛЕМЕНТЫ), постоянно присутствующий в тканях растений и животных. Важный компонент минерального обмена животных и человека и минерального питания растений, кальций выполняет в организме разнообразные функции. В составе апатита (см. АПАТИТ), а также сульфата и карбоната кальций образует минеральный компонент костной ткани. В организме человека массой 70 кг содержится около 1 кг кальция. Кальций участвует в работе ионных каналов (см. ИОННЫЕ КАНАЛЫ), осуществляющих транспорт веществ через биологические мембраны, в передаче нервного импульса (см. НЕРВНЫЙ ИМПУЛЬС), в процессах свертывания крови (см. СВЕРТЫВАНИЕ КРОВИ) и оплодотворения. Регулируют обмен кальция в организме кальциферолы (см. КАЛЬЦИФЕРОЛЫ) (витамин D). Недостаток или избыток кальция приводит к различным заболеваниям — рахиту (см. РАХИТ), кальцинозу (см. КАЛЬЦИНОЗ) и др. Поэтому пища человека должна в нужных количествах содержать соединения кальция (800—1500 мг кальция в сутки). Содержание кальция высоко в молочных продуктах (таких, как творог, сыр, молоко), в некоторых овощах и других продуктах питания. Препараты кальция широко используются в медицине.dic.academic.ru Кальций — Википедия
Ка́льций — элемент главной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 20. Обозначается символом Ca (лат. Calcium). Простое вещество кальций (CAS-номер: 7440-70-2) — мягкий, химически активный щёлочноземельный металл серебристо-белого цвета. История и происхождение названия[править]Название элемента происходит от лат. calx (в родительном падеже calcis) — «известь», «мягкий камень». Оно было предложено английским химиком Хэмфри Дэви, в 1808 г. выделившим металлический кальций электролитическим методом. Дэви подверг электролизу смесь влажной гашёной извести с оксидом ртути HgO на платиновой пластине, которая являлась анодом. Катодом служила платиновая проволока, погруженная в жидкую ртуть. В результате электролиза получалась амальгама кальция. Отогнав из неё ртуть Дэви получил металл, названный кальцием. Соединения кальция — известняк, мрамор, гипс (а также известь — продукт обжига известняка) применялись в строительном деле уже несколько тысячелетий назад. Вплоть до конца XVIII века химики считали известь простым телом. В 1789 году А. Лавуазье предположил, что известь, магнезия, барит, глинозём и кремнезём — вещества сложные. Нахождение в природе[править]Из-за высокой химической активности кальций в свободном виде в природе не встречается. На долю кальция приходится 3,38 % массы земной коры (5-е место по распространенности после кислорода, кремния, алюминия и железа). Содержание элемента в морской воде — 400 мг/л[4]. Изотопы[править]Кальций встречается в природе в виде смеси шести изотопов: 40Ca, 42Ca, 43Ca, 44Ca, 46Ca и 48Ca, среди которых наиболее распространённый — 40Ca — составляет 96,97 %. Ядра кальция содержат магическое число протонов: Z = 20. Изотопы 4020Ca20 и 4820Ca28 являются двумя из пяти существующих в природе дважды магических ядер. Из шести природных изотопов кальция пять стабильны. Шестой изотоп 48Ca, самый тяжёлый из шести и весьма редкий (его изотопная распространённость равна всего 0,187 %), испытывает двойной бета-распад с периодом полураспада (4,39 ± 0,58)·1019 лет[5][6][7]. В горных породах и минералах[править]Большая часть кальция содержится в составе силикатов и алюмосиликатов различных горных пород (граниты, гнейсы и т. п.), особенно в полевом шпате — анортите Ca[Al2Si2O8]. В виде осадочных пород соединения кальция представлены мелом и известняками, состоящими в основном из минерала кальцита (CaCO3). Кристаллическая форма кальцита — мрамор — встречается в природе гораздо реже. Довольно широко распространены такие минералы кальция, как кальцит CaCO3, ангидрит CaSO4, алебастр CaSO4·0.5h3O и гипс CaSO4·2h3O, флюорит CaF2, апатиты Ca5(PO4)3(F,Cl,OH), доломит MgCO3·CaCO3. Присутствием солей кальция и магния в природной воде определяется её жёсткость. Кальций, энергично мигрирующий в земной коре и накапливающийся в различных геохимических системах, образует 385 минералов (четвёртое место по числу минералов). Миграция в земной коре[править]В естественной миграции кальция существенную роль играет «карбонатное равновесие», связанное с обратимой реакцией взаимодействия карбоната кальция с водой и углекислым газом с образованием растворимого гидрокарбоната: (равновесие смещается влево или вправо в зависимости от концентрации углекислого газа). Огромную роль играет биогенная миграция. В биосфере[править]Соединения кальция находятся практически во всех животных и растительных тканях ( www.wikiznanie.ru Кальций (Ca, Calcium) - влияние на организм, польза и вред, описаниеИстория кальцияКальций был открыт в 1808 году Хэмфри Дэви, который путём электролиза гашеной извести и оксида ртути получил амальгаму кальция, в результате процесса выгонки ртути из которой и остался металл, получивший название кальций. На латыни известь звучит как calx, именно это название и было выбрано английским химиком для открытого вещества. Общая характеристика кальцияКальций является элементом главной подгруппы II группы IV периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 20 и атомную массу 40,08. Принятое обозначение – Ca (от латинского - Calcium).
Физические и химические свойстваКальций является химически активным мягким щелочным металлом серебристо-белого цвета. Из-за взаимодействия с кислородом и углекислым газом поверхность металла тускнеет, поэтому кальций нуждается в особом режиме хранения – в обязательном порядке плотно закрытая ёмкость, в которой металл заливают слоем жидкого парафина или керосина. Суточная потребность в кальцииКальций – наиболее известный из необходимых человеку микроэлементов, суточная потребность в нём составляет от 700 до 1500 мг для здорового взрослого человека, но она увеличивается во время беременности и лактации, это нужно учитывать и получать кальций в виде препаратов.
Нахождение в природеКальций имеет очень высокую химическую активность, поэтому в свободном (чистом) виде не встречается в природе. Тем не менее, является пятым по распространённости в земной коре, в виде соединений имеется в осадочных (известняк, мел) и горных породах (гранит), много кальция содержит полевой шпат анорит. В живых организмах распространён достаточно широко, его наличие обнаружено в растениях, организмах животных и человека, где он присутствует, в основном, в составе зубов и костной ткани. Продукты питания богатые кальциемИсточники кальция: молочные и кисломолочные продукты (основной источник кальция), брокколи, капуста, шпинат, листья репы, капуста цветная, спаржа. Кальций содержат также яичные желтки, бобы, чечевица, орехи, инжир (calorizator). Еще хороший источник пищевого кальция — мягкие кости лосося и сардин, любые морепродукты. Чемпионом по содержанию кальция является кунжут, но только – в свежем виде. В организм кальций должен поступать в определенном соотношении с фосфором. Оптимальным соотношением этих элементов принято считать 1 : 1,5 (Са : Р). Поэтому правильно употреблять продукты питания, богатые этими минералами одновременно, например, говяжью печень и печень жирных сортов рыб, зелёный горошек, яблоки и редис.
Усвояемость кальцияПрепятствием для нормального усвоения кальция из пищевых продуктов является употребление в пищу углеводов в виде сладостей и щелочей, которые нейтрализуют соляную кислоту желудка, необходимую для растворения кальция. Процесс усвоения кальция достаточно сложен, поэтому иногда недостаточно получать его только с пищей, необходим дополнительный приём микроэлемента. Взаимодействие с другимиДля улучшения всасывания кальция в кишечнике необходим витамин D, который имеет свойство облегчать процесс усвоения кальция. При приёме кальция (в виде добавок) в процессе еды происходит блокировка всасывания железа, но приём препаратов кальция отдельно от пищи никак не влияет на этот процесс. Полезные свойства кальция и его влияние на организмПочти весь кальций организма (от 1 до 1,5 кг) находится в костях и зубах. Кальций участвует в процессах возбудимости нервной ткани, сократимости мышц, процессах свертываемости крови, входит в состав ядра и мембран клеток, клеточных и тканевых жидкостей, обладает антиаллергическим и противовоспалительным действием, предотвращает ацидоз, активирует ряд ферментов и гормонов. Кальций также участвует в регуляции проницаемости клеточных мембран, оказывает действие, противоположное натрию.
Признаки нехватки кальцияПризнаками нехватки кальция в организме являются такие, на первый взгляд, не связанные между собой симптомы:
Причины нехватки кальцияПричинами нехватки кальция могут служить несбалансированные диеты (особенно голодания), низкое содержание кальция в пище, курение и увлечение кофе и кофеинсодержащими напитками, дисбактериоз, болезни почек, щитовидной железы, беременность, периоды лактации и менопаузы. Признаки избытка кальцияИзбыток кальция, который может возникнуть при чрезмерном употреблении молочных продуктов или неконтролируемом приёме препаратов, характеризуется сильной жаждой, тошнотой, рвотой, потерей аппетита, слабостью и усиленным мочеотделением.
Применение кальция в жизниКальций нашёл применение в металлотермическом получении урана, в виде природных соединений используется как сырьё для производства гипса и цемент, как средство дезинфекции (всем известная хлорка). Автор: Виктория Н. (специально для Calorizator.ru)Копирование данной статьи целиком или частично запрещено. www.calorizator.ru КальцийКа́льций — элемент главной подгруппы второй группы, четвёртого периода периодической системы химических элементов, с атомным номером 20. Обозначается символом Ca (лат. Calcium). Простое вещество кальций (CAS-номер: 7440-70-2) — мягкий, химически активный щёлочноземельный металл серебристо-белого цвета. История и происхождение названияНазвание элемента происходит от лат. calx (в родительном падеже calcis) — «известь», «мягкий камень». Оно было предложено английским химиком Хэмфри Дэви, в 1808 г. выделившим металлический кальций электролитическим методом. Дэви подверг электролизу смесь влажной гашёной извести с оксидом ртути HgO на платиновой пластине, которая являлась анодом. Катодом служила платиновая проволока, погруженная в жидкую ртуть. В результате электролиза получалась амальгама кальция. Отогнав из неё ртуть, Дэви получил металл, названный кальцием. Соединения кальция — известняк, мрамор, гипс (а также известь — продукт обжига известняка) применялись в строительном деле уже несколько тысячелетий назад. Вплоть до конца XVIII века химики считали известь простым телом. В 1789 году А. Лавуазье предположил, что известь, магнезия, барит, глинозём и кремнезём — вещества сложные. ПолучениеСвободный металлический кальций получают электролизом расплава, состоящего из CaCl2 (75-80 %) и KCl или из CaCl2 и CaF2, а также алюминотермическим восстановлением CaO при 1170—1200 °C: 4CaO + 2Al → CaAl2O4 + 3Ca. Физические свойстваМеталл кальций существует в двух аллотропных модификациях. До 443 °C устойчив α-Ca с кубической гранецентрированной решеткой (параметр а = 0,558 нм), выше устойчив β-Ca с кубической объемно-центрированной решеткой типа α-Fe (параметр a = 0,448 нм). Стандартная энтальпия ΔH0 перехода α → β составляет 0,93 кДж/моль. При постепенном повышении давления начинает проявлять свойства полупроводника, но не становится полупроводником в полном смысле этого слова (металлом уже тоже не является). При дальнейшем повышении давления возвращается в металлическое состояние и начинает проявлять сверхпроводящие свойства (температура сверхпроводимости в шесть раз выше, чем у ртути, и намного превосходит по проводимости все остальные элементы). Уникальное поведение кальция похоже во многом на стронций (т. е. параллели в периодической системе сохраняются). Химические свойстваКальций — типичный щелочноземельный металл. Химическая активность кальция высока, но ниже, чем всех других щелочноземельных металлов. Он легко взаимодействует с кислородом, углекислым газом и влагой воздуха, из-за чего поверхность металлического кальция обычно тускло серая, поэтому в лаборатории кальций обычно хранят, как и другие щелочноземельные металлы, в плотно закрытой банке под слоем керосина или жидкого парафина. Источник: Википедия Другие заметки по химии edu.glavsprav.ru Кальций и его характеристикиОбщая характеристика кальцияКальций принадлежит к числу самых распространенных в природе элементов. В земной коре его содержится приблизительно 3% (масс.). Он встречается в виде многочисленных отложений известняков и мела, а также мрамора, которые представляют собой природные разновидности карбоната кальция CaCO3. В больших количествах встречаются также гипс CaSO4×2h3O, фосфорит Ca3(PO4)2 и, наконец, различные содержащие кальций силикаты. В виде простого вещества кальций представляет собой ковкий, довольно твердый металл белого цвета (рис.1). На воздухе быстро покрывается слоем оксида, а при нагревании сгорает ярким красноватым пламенем. С холодной водой кальций реагирует сравнительно медленно, но из горячей воды быстро вытесняет водород, образуя гидроксид. Рис. 1. Кальций. Внешний вид. Атомная и молекулярная масса кальцияОтносительной молекулярная масса вещества (Mr) – это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента (Ar) — во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода. Поскольку в свободном состоянии кальций существует в виде одноатомных молекул Ca, значения его атомной и молекулярной масс совпадают. Они равны 40,078. Изотопы кальцияИзвестно, что в природе кальций может находиться в виде четырех стабильных изотопов 40Ca,42Ca, 43Ca, 44Ca, 46Ca и 48Ca, с явным преобладанием изотопа 40Ca (99,97%). Их массовые числа равны 40, 42, 43, 44, 46 и 48 соответственно. Ядро атома изотопа кальция 40Ca содержит двадцать протонов и двадцать нейтронов, а остальные изотопы отличаются от него только числом нейтронов. Существуют искусственные изотопы кальция с массовыми числами от 34-х до 57-ми, среди которых наиболее стабильным является 41Ca с периодом полураспада равным 102 тысячи лет. Ионы кальцияНа внешнем энергетическом уровне атома кальция имеется два электрона, которые являются валентными: 1s22s22p63s23p64s2. В результате химического взаимодействия кальций отдает свои валентные электроны, т.е. является их донором, и превращается в положительно заряженный ион: Ca0-2e → Ca2+. Молекула и атом кальцияВ свободном состоянии кальций существует в виде одноатомных молекул Ca. Приведем некоторые свойства, характеризующие атом и молекулу кальция:
Сплавы кальцияКальций служит легирующим компонентом некоторых свинцовых сплавов. Примеры решения задачru.solverbook.com общая характеристика с фото; суточная потребность в нем организмаОписание
Кальций – элемент, входящий в пятерку самых распространенных в мире. Он входит в состав извести, мрамора, гипса и, наконец, костей всех живых организмов. Представляет собой мягкий металл, серебристо-белого цвета (см. фото), высоко активен в чистом виде.
Люди знакомы с соединениями кальция еще с древних времен, ведь известь использовали в строительстве.
Металл был синтезирован в в 1808 году английским ученым Г. Деви из гашенной извести. Название ему дали от латинского слова calx, как раз и означающего известь.
Как микроэлемент, он играет важную роль в функционировании любого живого организма, ведь количество его в тканях очень высоко – около 20 грамм на 1 кг массы всего тела и 90% этого элемента находят в костях и зубах.
Действие кальция и его роль в организме
В организме кальций присутствует в виде солей, которые представляют собой строительные материалы для костной ткани, зубов и ногтевых пластин. Также он крайне необходим для мышц, нервной системы и иммунитета. Является веществом снижающим и предотвращающим аллергические заболевания.
Элемент плохо усваивается в желудке, с этим фактом связана задача соблюдения нужного его содержания в крови. Усвоению препятствуют кислоты, содержащиеся в малопитательных злаках (ячневая и кукурузная крупы), в шпинате и щавеле.
Кальций играет особую роль в процессе сокращения тканей мышц, особенно в работе сердечной мышцы. Недостаток может привести к гиперактивности нервной системы и ослаблению мышц, что в свою очередь способно стимулировать эпилептические припадки.
В Швейцарии заметили интересный факт - в горной деревне с идеально чистым воздухом и знаменитыми альпийскими лугами обнаружили, что часть населения страдает мигренями, бессонницей, болезнями желудка и онкологией, в следствии чего такие люди принимали массу лекарств. Местный врач обратил внимание, что эта группа людей в основной массе проживала возле шоссе, где воздух оказался загрязненным вредными отходами проезжающих автомобилей (олово, бензопирен). Лечение было назначено в виде правильного рациона, «укомплектованного» всем наборов требуемых элементов и витаминов, в особенности аскорбиновой кислотой и витаминами группы В. Также жителям было рекомендовано добавлять кальций и магний, которые смогли устранить олово, а витамины, в свою очередь, поспособствовали укреплению организма.
Поступление кальция в достаточном количестве сможет предотвратить остеопороз и сохранить здоровый скелет и зубы. Это связано с тем, что нарушение баланса элемента в крови будет восстанавливаться за счет костных тканей, что может привести к их хрупкости.
Кальций – очень уникальный по своим качествам и воздействию на человеческий организм элемент. Он способен оказывать практически волшебную помощь.
Например, очень повезло в этом отношении людям, проживающим в местностях с жесткой питьевой водой. Они в разы реже страдают заболеваниями, связанными с сердечно-сосудистой системой (инфаркты, высокое давление, высокий уровень холестерина). Здесь даже жирная пища не наносит такого вреда, как жителям других регионов. Конечно, увлекаться не стоит.
Все дело в том, что кальций и магний, содержащиеся в жесткой воде при реакции с насыщенными жирами превращают их в некоторую субстанцию, которую желудок неспособен усваивать и выводит естественным путем. Получается, что жесткая вода живительна, и человек ее пьющий избавится от излишков холестерина, варикоза, гипертонии и тромбофлебитов. А также является «лекарством» от болезни нашего времени – ожирения.
В жесткой воде обнаружен целый комплекс полезных микроэлементов (кальций, магний, литий и др), которые и придают ей вкус. А вот в мягкой воде в большой массе концентрируется натрий, и она годится лишь для стирки.
Что делать тем, кому не повезло? Употребление100 мг кальция и 60 мг магния будет аналогично действию 2 литров жесткой воды. Или практически равноценно. Но стоит учитывать, что фосфор связывает кальций, поэтому не стоит пить газировки, которые в большом количестве фосфор содержат и позаботиться о полноценном питании еще со времени рождения ребенка, а в особенности для подростков, у которых происходит активное развитие нервной системы в частности. Иначе ко времени полового созревания мы получим человека с ослабленными нервными волокнами, рискующего уже в 20-40 лет приобрести рассеянный склероз.
Кальций в комплексе с витамином D и фосфором является основой профилактики и лечения рассеянного склероза и других неврологических заболеваний. Ведь жители тропических стран практически не страдают от этих недугов (обилие ультрафиолета синтезирует кальциферол или витамин D).
Добавление йода поможет кальцию полностью усвоиться организмом, это доказывает столь знаменитый во всем мире коралловый кальций и жители прибрежных солнечных районов.
Не стоит забывать о том, что большое количество кальция может не усваиваться, и причин тому много. Например, прием мочегонных и слабительных средств, которые практически вымывают кальций и другие микроэлементы. Кстати, эти средства входят в состав чаев для похудения. Этими качествами также обладают чаи, кофе, алкоголь и газированные сладкие напитки. Благодаря одним только Коле и Пепси человек за несколько лет может попрощаться с зубами.
Суточная норма - какова потребность в элементе?
Беременным и кормящим матерям нужно употреблять по 1,5 и 2 грамма соответственно, в связи с увеличенным расходом. Кстати, заметили, что именно мамы чаще всего жалуются, что ребенок «съел» их зубы и волосы. Ведь, построение организма малыша начинается еще в утробе матери и кушать витамины и микроэлементы она должна за двоих.
Недостаток кальция - причины дефицита и его симптомы
Недостаток микроэлемента может привести к большим неприятностям как внутреннего, так и внешнего характера. Рассмотрим их подробнее.
Чем больше наш возраст, тем меньше способность усваивать кальций. Но на помощь могут прийти многочисленные препараты вроде глюканата кальция или добавление в пищу костной муки.
Одной из причин недостатка кальция является несбалансированное питание. Многие люди сознательно исключают из своего рациона молочные продукты и употребляют каши, картофель, мясо и хлеб, мотивируя тем, что эта пища «природна» для наших народов. Во-первых, не учитывается то, что продукты сейчас совсем не те. А во-вторых, то, что в пожилом возрасте (50-60 лет) люди еще 200 лет назад были уже достаточно немощны, особенно это касалось женщин.
Нехватка кальция чаще всего появляется при высоком уровне потребности (рост, беременность, лактация), а также при неправильном питании - употребление картофеля, каш, хлеба, мяса при полном исключении молочных продуктов, в том числе сыра).
В результате мы получим такие симптомы, как слабость, хроническая усталость, болезненные ощущения в мышцах и костях, нарушение роста, деформацию костей, приводящую к нарушению походки, остеоартроз, Болезнь Кашина-Бека (болезнь впозвоночнике и суставах конечностей), аллергия, проблемы со свертываемостью крови и ослабление иммунитета.
Избыток кальция - каковы признаки?
Избыток кальция в организме возникает из-за чрезмерного получения витамина D, а соответственно, и повышенного усвоения кальция. Также причиной может послужить передозировка медикаментов и БАДов и нарушение обмена кальция из-за проблем с центрально-нервной системой и щитовидной железой.
В каких источниках питания содержится?
Самыми лучшими поставщиками кальция считают кисломолочные продукты, в том числе и творог. Но последнее время находится немало сторонников теории, что такой кальций неестественен для организма человека и требует большого расхода энергии для усвоения. К тому же такие продукты образуют много кислоты в желудке, на нейтрализацию, которой и идет кальций. Восполнить пробел помогут орехи любого вида (50-100 грамм в день).
Сыры же, продающиеся в наших магазинах, часто содержат в себе большое количество соли и красителей. К тому же часто для удлинения срока хранения этот продукт подвергается сильной термической обработке.
Кальций и фосфор в комплексе находятся в яблоках, бобовых, огурцах, капусте всех видов и особенно в цветной, в твороге и белых сырах.
Кальцием богаты абрикосы, апельсины, виноград, крыжовник, ананасы, персики, свекла, морковь, мед, миндаль, кунжут и кожица фруктов и овощей. А фосфор можно найти во всех орехах, чечевице, пшенице, мясе и грибах.
Как можно заметить, достаточно просто составить правильное меню для всей семьи, чтобы избежать недостатка полезных микроэлементов и витамина D, которые занимаются постройкой организма.
Яичная скорлупа, как источник кальция
Кальций из яичной скорлупы практически полностью усваивается нашим организмом по той причине, что ее химический состав практически полностью аналогичен химическому комплексу костей и зубов человека.
Скорлупу яиц применяют практически повсеместно в качестве источника кальция: добавки в почву и прикорм для животных, для стирки в качестве отбеливателя, в составе народных рецептов.
Она на 90% состоит из карбоната кальция и содержит еще около 20 полезных микроэлементов. В ней одной можно найти кремний и молибден, которые практически отсутствуют в наших продуктах питания. Скорлупа, кроме всего прочего, прекрасно выполняет функцию вывода радионуклеидов и препятствует накоплению в организме радиоактивных токсинов.
Ее можно спокойно включать в питание детей до трех лет, что позволяет положительно влиять на активный рост скелета и предотвращать развитие рахита, анемии и диатеза. А взрослые могут принимать скорлупу как профилактическое средство против кариеса, хрупкости ногтей, кровоточивости десен, остеопороза.
Способ употребления: яйцо вымыть с мылом, удалить содержимое, подсушить и прокалить в течение 2 минут для стерилизации. Не забудьте удалить внутреннюю пленку. Скорлупу растереть до состояния порошка в ступке или в кофемолке. Интересный факт – скорлупа, источенная в ступе из фарфора, проявляет наиболее эффективное действие. Полученный порошок можно употреблять вместе с едой или отдельно с лимонным соком. Малышам с 6 месяцев нормой будет количество порошка на кончике маленькой ложки, а взрослым 1 ст. ложку в день.
Яичная скорлупа выступает лекарственным средством при:
Также существуют рецепты для лечения астмы и язвы двенадцатиперстной кишки, но ВАЖНО проконсультироваться с лечащим врачом по поводу приема народных средств.
Показания к назначению
Показания к назначению микроэлемента в качестве лекарственного и вспомогательного препарата:
xcook.info Информация о Кальции и его полезных свойствахИз всех элементов в человеческом организме кальций содержится в максимальном количестве: на каждый килограмм массы тела приходится около 20 г кальция. Таким образом, в организме взрослого человека находится 1-1,5 кг этого крайне полезного элемента, причем из всех его запасов около 98% сосредоточено в хрящевой и костной тканях. Оставшаяся часть постоянно присутствует в крови и других жидкостях организма. Поскольку старые костные клетки распадаются, для своевременного образования новой костной ткани запасы кальция должны постоянно пополняться, в противном случае организм будет восполнять нехватку из собственных зубов и костей, разрушая их и ослабляя. В среднем человек нуждается в потреблении 0,6 -1,1 г кальция в сутки. Он крайне важен для развития детского организма. При беременности и кормлении грудью суточная потребность увеличивается до 1,5-2 г. Действие и свойства кальцияПомимо построения костей и зубов кальций выполняет и другие функции: активно участвует в процессах свертывания крови, играет важную роль в работе ферментных систем, влияет на деятельность сердечно-сосудистой и нервно-мышечной систем. Кальций снижает проницаемость сосудов, усиливает сопротивляемость организма к токсинам и инфекциям, обладает противовоспалительным действием. Нельзя переоценить значение этого элемента для полноценного внутриутробного развития плода: соли кальция закладывают основу жизненно-важных систем и процессов организма ребенка. Избыток и недостаток кальцияВследствие дефицита кальция в человеческом организме развивается остеопороз, кариес, а также деформация и размягчение костей (остеомоляция). Избыток элемента может спровоцировать повышение кровяного давления и привести к отложению солей кальция в тканях, в которых изначально они присутствовать не должны (кальциноз). Пищевые источники кальцияМаксимальное содержание кальция – в молочных продуктах, сырах, орехах. Также он встречается в зеленых овощах: чесноке, петрушке, капусте, сельдерее и в некоторых ягодах и фруктах. Ряд продуктов, например шпинат, щавель, злаковые, напротив, мешают усвоению кальция из продуктов питания, поэтому стоит учитывать это взаимодействие при составлении пищевого рациона. www.100vitaminov.ru |
Цельнозерновые злаковые
Цельнозерновые злаковые – это «медленные» углеводы. Тут и хлеб, и макаронные изделия, хотя бы на 50% состоящие из цельнозерновой муки, и нешлифованный коричневый рис.
Жиры
Только полезные жиры! Оливковое, рапсовое, подсолнечное и другие растительные масла подойдут для салата.
Фрукты
Употребляйте достаточно фруктов – всех цветов и размеров. Они обеспечивают вас витаминами и микроэлементами и отлично заменят десерт. |
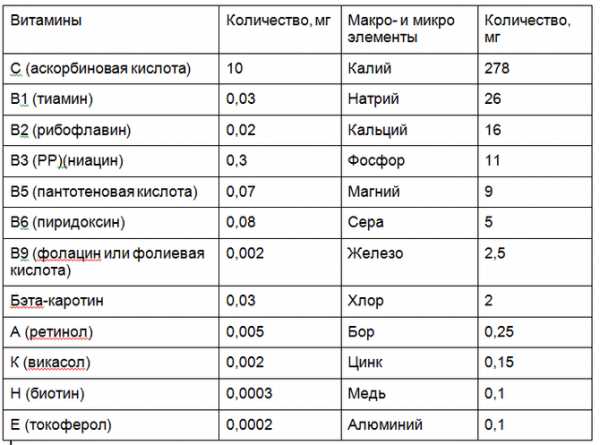
|||||||||||||||||||||||||||||



 Умеренно твёрдый[1], серебристо-белый металл
Умеренно твёрдый[1], серебристо-белый металл 





 Самый близкий напарник кальция – фосфор, и друг без друга они не смогут усваиваться. За их равновесие в крови отвечает витамин D. Нарушение этого соотношения приведет к истощению «костного запаса» в зубах, ногтях, суставах, а то и заменять его стронцием, который приводит к возникновению наростов и шишек на костных тканях.
Самый близкий напарник кальция – фосфор, и друг без друга они не смогут усваиваться. За их равновесие в крови отвечает витамин D. Нарушение этого соотношения приведет к истощению «костного запаса» в зубах, ногтях, суставах, а то и заменять его стронцием, который приводит к возникновению наростов и шишек на костных тканях. Суточная норма микроэлемента в зависимости от возраста и пола меняется. Например, взрослым требуется 0,8-12 грамм, детям до 12 лет – 1 грамм, а подросткам уже 1,4 грамма. Как можно заметить в зависимости от возраста потребность уменьшается, т.к. организму требуется лишь поддерживать необходимый уровень, в то время как детям нужны большие запасы строительных материалов.
Суточная норма микроэлемента в зависимости от возраста и пола меняется. Например, взрослым требуется 0,8-12 грамм, детям до 12 лет – 1 грамм, а подросткам уже 1,4 грамма. Как можно заметить в зависимости от возраста потребность уменьшается, т.к. организму требуется лишь поддерживать необходимый уровень, в то время как детям нужны большие запасы строительных материалов. Потеря кальция из костных тканей процесс длительный и незаметный и может происходить из-за того, что кальций из продуктов питания может мало усваиваться по причинам нарушения работоспособности желез внутренней секреции. К сожалению, заметить этот процесс становится возможным лишь, когда уже возникают болезненные ощущения в костях и они становятся ломкими без повода. Но радует тот момент, что процесс может быть обратимым, что показали многочисленные исследования на добровольцах довольно преклонного возраста (80-90 лет). Им давали довольно высокие дозы микроэлемента с витамином D и не замечали отложения кальция в организме. Зато заметили снижение количества холестерина и общее улучшение состояния.
Потеря кальция из костных тканей процесс длительный и незаметный и может происходить из-за того, что кальций из продуктов питания может мало усваиваться по причинам нарушения работоспособности желез внутренней секреции. К сожалению, заметить этот процесс становится возможным лишь, когда уже возникают болезненные ощущения в костях и они становятся ломкими без повода. Но радует тот момент, что процесс может быть обратимым, что показали многочисленные исследования на добровольцах довольно преклонного возраста (80-90 лет). Им давали довольно высокие дозы микроэлемента с витамином D и не замечали отложения кальция в организме. Зато заметили снижение количества холестерина и общее улучшение состояния. При подведении итогов: гипокальцемия вызывается рядом причин, таких как ненасыщенные микроэлементом пища и вода, голодание, аллергия, грибковые заболевания, дисбактериоз, дефицит кальциферола (D), проблемы с щитовидной железой, высокий уровень расхода кальция в силу разных болезней, употребление никотина и кофеина, прием мочегонных и слабительных лекарств, панкреатит. Также в значительной мере влияет на количество кальция избыток калия, магния, натрия, кобальта, железа, фосфора,свинца и цинка.
При подведении итогов: гипокальцемия вызывается рядом причин, таких как ненасыщенные микроэлементом пища и вода, голодание, аллергия, грибковые заболевания, дисбактериоз, дефицит кальциферола (D), проблемы с щитовидной железой, высокий уровень расхода кальция в силу разных болезней, употребление никотина и кофеина, прием мочегонных и слабительных лекарств, панкреатит. Также в значительной мере влияет на количество кальция избыток калия, магния, натрия, кобальта, железа, фосфора,свинца и цинка. Признаками этого процесса являются запоры, потеря аппетита, постоянная жажда. При более продолжительном дефиците могут возникать гипертония, отложение солей элемента во всех тканях органов, и даже в эпидермисе. Возможно развитие гастрита, и даже язвы желудка по причине повышения кислотности. Повышается уровень солей в моче и развивается нефрокальциноз (отложение камней). Переизбыток может вызвать болезни сердца – брадикардию и стенокардию.
Признаками этого процесса являются запоры, потеря аппетита, постоянная жажда. При более продолжительном дефиците могут возникать гипертония, отложение солей элемента во всех тканях органов, и даже в эпидермисе. Возможно развитие гастрита, и даже язвы желудка по причине повышения кислотности. Повышается уровень солей в моче и развивается нефрокальциноз (отложение камней). Переизбыток может вызвать болезни сердца – брадикардию и стенокардию. В принципе, самым надежным источником можно назвать продукты питания, которые содержат не только кальций, но и фосфор, витамины D, В9 и аскорбиновую кислоту. К таким относят говяжью печень и печень рыб, морепродукты, сливочное масло и сырой желток яиц.
В принципе, самым надежным источником можно назвать продукты питания, которые содержат не только кальций, но и фосфор, витамины D, В9 и аскорбиновую кислоту. К таким относят говяжью печень и печень рыб, морепродукты, сливочное масло и сырой желток яиц.