НОВОСТИ |
Словарь химических формул. С2Он что это
dic.academic.ru Этиловый спирт — Циклопедия
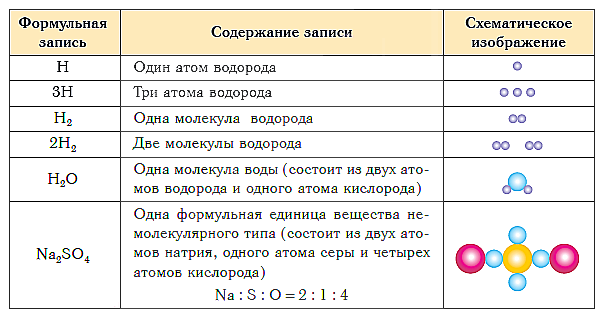
Этиловый спирт (этанол, метилкарбинол, винный спирт) — одноатомный алифатический спирт, бесцветная легкоподвижная жидкость с характерным запахом и жгучим вкусом. Относится к сильнодействующим наркотикам, вызывающим сначала возбуждение, а затем паралич нервной системы. Имеет формулу Ch4Ch3OH (упрощённо: С2Н5ОН)[1]. Этиловый спирт получают сбраживанием пищевого сырья. С 1930−1950-х гг. были разработаны способы получения синтетического спирта гидратацией этилена и гидрированием ацетальдегида. Гидратация этилена стала основным способом производства этилового спирта в 1970-е гг.[2] Этиловый спирт прижигает кожу и слизистые оболочки; при приёме внутрь угнетает центры торможения мозга, имеет наркотический эффект: вызывает опьянение, а при многократном употреблении вызывает алкоголизм. Также вредно воздействует на зародыш ребенка. [править] Физические свойстваЭтиловый спирт — горючая прозрачная жидкость. Температура плавления = - 114.15 °С, температура кипения = 78,39 °С, плотность 0,7893 г/см³. [2] Молярная масса = 46,069.[3] [править] Химические свойстваЭтанол смешивается во всех соотношениях с водой, спиртами, диэтиловым эфиром, глицерином, хлороформом, ацетальдегидом, бензином; образует азеотропные смеси с водой; бензолом; гексаном; толуолом; этилацетатом, а также тройные азеотропные смеси. Этиловый спирт реагирует с щелочными металлами и с магнием с образованием этилатов и водорода. Например при реакции с натрием Na образуется этилат натрия: 2C2H5OH + 2Na → 2C2H5ONa + Н2↑ Аналогично идёт реакция с калием K: 2C2H5OH + 2К → 2С2Н5ОК + Н2↑ Этанол вступает в реакцию гидрогалогенирования в присутствии хлорида цинка: Ch4Ch3OH + HCl → Ch4Ch3Cl + h3O При поджигании на воздухе этиловый спирт горит бледно-голубым, синеватым пламенем: C2H5OH + 3O2 → 2CO2↑ + 3h3O При нагревании в колбе с холодильником этанола с галогеноводородной кислотой, например с HBr (или смесью NаHBr и h3SO4, дающей при реакции бромистый водород), то будет отгоняться маслянистая жидкость — бромистый этил C2H5Вг: C2H5OH + HBr → C2H5HBr + h3O При нагревании с серной кислотой (при температуре меньше 120 °C), этиловый спирт превращается в диэтиловый эфир (реакция дегидратации): 2C2H5OH → C2H5-O-C2H5 + h3O Вступает в реакцию дегидратации в присутствии серной кислоты при температуре больше 120 °C с образованием непредельного углеводорода: Ch4Ch3OH → Ch3Ch3 + h3O Этиловый спирт реагируя с карбоновыми кислотами в присутствии серной кислоты при нагревании приводит к реакции этерификации, например в реакции с уксусной кислотой образуется уксусно-этиловый эфир: СН3СООН + С2Н5ОН → СН3СООC2H5 + h3O Этанол получают в основном двумя способами: микробиологическим (спиртовое брожение) и синтетический (гидратация этилена): Спиртовое брожение представляет собой биохимический процесс превращения сахара в спирт с выделением углекислого газа под воздействием дрожжей вида Saccharomyces cerevisiae и др., по формуле: C6h22O6 → 2C2H5OH + 2CO2 + 27 ккал Данный метод в основном применяется в пищевой промышленности, не только для производства этилового спирта, но и например при производстве хлебобулочных изделий, при этом дрожжи, выделяемый углекислый газ разрыхляет и поднимает тесто. В химической промышленности, используют гидратацию этилена. Гидратацию можно вести по двум схемам: Первый вариант — прямая гидратация при температуре 300 °C, давлении 7 МПа, в качестве катализатора применяют ортофосфорную кислоту, нанесённую на силикагель, активированный уголь или асбест: Ch3=Ch3 + h3O → C2H5OH Второй вариант — гидратация через стадию промежуточного эфира серной кислоты, с последующим его гидролизом (при температуре 80—90 °С и давлении 3,5 МПа: Ch3=Ch3 + h3SO4 → Ch4-Ch3-OSO2OH (этилсерная кислота) Ch4-Ch3-OSO2OH + h3O → C2H5OH + h3SO4 Реакция осложняется образованием диэтилового эфира. [править] Практическое значениеЭтиловый спирт широко применяется в промышленности. Этиловый спирт идёт на изготовление спиртных напитков. Этанол является растворителем в лакокрасочной и фармацевтической промышленности, в производстве кинофотоматериалов, товаров радиоэлектроники и бытовой химии, взрывчатых веществ и пр. Этот спирт служит сырьём для производств диэтилового эфира, хлороформа, тетраэтилсвинца, ацетальдегида, уксусной кислоты, этилацетата, этиламина, этилакрилатов, этилсиликатов и пр. Этиловый спирт — компонент антифриза, топливо для реактивных двигателей. Для технических целей часто используют денатурированный спирт (денатурат) — спирт-сырец, содержащий добавки красителя, окрашивающего этиловый спирт в сине-фиолетовый цвет, и специфических веществ, придающих ему неприятный запах и вкус. Денатурат ядовит. В медицине этиловый спирт применяется для дезинфекции, как поверхностное сосудорасширяющее средство, коагулянт белка, в том числе при лечении ожогов. Мозг и алкоголь — Вячеслав Дубынин // ПостНаука [15:27]Этанол чрезвычайно гигроскопичен, при концентрации выше 70% (по объему) прижигает кожу и слизистые оболочки; при приёме внутрь угнетает центры торможения мозга, вызывает опьянение, при многократном употреблении вызывает алкоголизм. ПДК в атмосфере воздухе 5 мг/м³, в воздухе рабочей зоны 1000 мг/м³. Помимо признанного ВОЗ и ГОСТ наркотического действия, этиловый спирт обладает тератогенным действием (отрицательно воздействует на зародыш, см. в частности Зависимость числа дебилов от потребления алкоголя), его употребление многократно повышает риски преступности и психиатрических проблем, а также является одной из ведущих причин смертности в России (в частности, вследствие убийств, самоубийств и ведущих причин смертности — атеросклеротического кардиосклероза и нарушения мозгового кровообращения). cyclowiki.org Урок 5. Химическая формула – HIMI4KAВ уроке 5 «Химическая формула» из курса «Химия для чайников» дадим определение химическим формулам и их индексам, а также выясним различия химических формул веществ молекулярного и немолекулярного строения. Напоминаю, что в прошлом уроке «Сложные вещества» мы дали определение химическим соединениям, рассмотрели различия органических и неорганических соединений, а также выяснили, что означает качественный и количественный состав.  Состав любого вещества выражается в виде химической формулы. Химическая формула — это условная запись состава вещества с помощью химических знаков и индексов. Качественный состав показывается с помощью знаков (символов) химических элементов, а количественный — с помощью индексов, которые записываются справа и чуть ниже знаков химических элементов. Индекс — число атомов данного химического элемента в формуле вещества. Например, химическая формула простого вещества водорода записывается так: 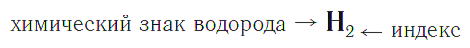 и читается «аш-два». Химические формулы веществ молекулярного строенияФормулы двухатомных молекул: кислорода — О2 («о-два»), хлора — Сl2 («хлор-два»), азота — N2 («эн-два»). Трехатомная молекула озона и восьмиатомная молекула серы обозначаются формулами О3 («о-три») и S8 («эс-восемь»). Формулы молекул сложных веществ также отображают их качественный и количественный состав. Например, формула воды, как вы уже, наверное, хорошо знаете, Н2О («аш-два-о»), метана — СН4 («це-аш-четыре»), а аммиака — Nh4 («эн-аш-три»). Точно так же читаются формулы любых сложных веществ. Например, формула серной кислоты — h3SO4 («аш-два-эс-о-четыре»), а глюкозы — C6h22O6 («це-шесть-аш-двенадцать-о-шесть»). Химические формулы веществ молекулярного строения (их называют молекулярными формулами) показывают состав элементарных частей, т. е. условных «кирпичиков», из которых состоят эти вещества. Такими элементарными составными частями (элементарными структурными единицами, или просто структурными единицами) в данном случае являются молекулы. Химические формулы веществ немолекулярного строенияА если вещество имеет немолекулярное строение? Химические формулы простых веществ такого типа (например, металлов) записывают просто знаками соответствующих элементов без индексов (или, вернее, с индексом, равным единице, которая не записывается). Так, формула простого вещества железа — Fe, меди — Cu, алюминия — Al. Состав сложных веществ немолекулярного строения выражают с помощью формул, которые показывают простейшее соотношение чисел атомов разных химических элементов в этих веществах. Такие формулы называются простейшими. Например, простейшая формула кварца — главной составной части речного песка — SiO2. Она показывает, что в кристалле кварца на один атом кремния приходятся два атома кислорода, т. е. простейшее соотношение чисел атомов кремния и кислорода в этом веществе равно 1:2. Простейшая формула Al2O3 показывает, что в этом соединении простейшее соотношение между числами атомов алюминия и кислорода равно 2:3. Группа атомов, состав которой соответствует простейшей формуле вещества немолекулярного строения, называется его формульной единицей. Формульная единица, поваренной соли NaCl («натрий-хлор») — группа из одного атома натрия и одного атома хлора. Формульная единица мела CaCO3 («кальций-це-о-три») — группа из одного атома кальция, одного атома углерода и трех атомов кислорода. Формулы более сложных соединений немолекулярного строения читаются аналогично. Дополнительно указывается только число групп атомов, заключенных в круглые скобки: Al2(SO4)3 («алюминий-два-эс-о-четыре-трижды»), Mg(NO3)2 («магний-эн-о-три-дважды») и т. д. Таким образом, структурными единицами веществ молекулярного строения являются молекулы. Структурными единицами веществ немолекулярного строения являются их формульные единицы. В таблице ниже показаны формульная запись и схематическое изображение состава веществ различного типа.
Краткие выводы урока:
Надеюсь урок 5 «Химическая формула» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. himi4ka.ru СпиртыКлассификация спиртов- одноатомные R-OH; например: - двухатомные (гликоли, диолы) R(OH)2; например: - трехатомные (триолы) R(OH)3; например: Двух-, трех- и т. д. спирты называются многоатомными. - алициклические; например: - ароматические; например, бензиловый спирт (см. выше). - первичные RCh3OH: группа -ОН связана с первичным атомом углерода; СН3-ОН; СН3-СН2-ОН; СН3-СН2-СН2-ОН метанол; этанол; пропанол-1. - вторичные RR'CHOH: группа -ОН связана с вторичным атомом углерода; - третичные RR'R'COH: группа -ОН связана с третичным атомом углерода. Предельные одноатомные спирты (алканолы)Общая формула гомологического ряда предельных одноатомных спиртов - Cnh3n+1OH; Cnh3n+2O или R-OH. Изомерия и номенклатураИзомерия одноатомных спиртов связана со строением углеродного скелета (например, бутанол-2 и 2-метилпропанол-2) и с положением группы ОН (пропанол-1 и пропанол-2). Названия спиртов образуют, добавляя окончание -ол к названию углеводорода с самой длинной углеродной цепью, включающей гидроксильную группу. Нумерацию цепи начинают с того края, ближе к которому расположена гидроксильная группа. Кроме того, широко распространена заместительная номенклатура, по которой название спирта производится от соответствующего углеводородного радикала с добавлением, слова "спирт", например: C2H5OH - этанол или этиловый спирт. Электронное строение молекул алканоловМолекулы алканолов содержат полярные связи С-Н, С-О, О-Н. Наиболее полярной является связь О-Н; поэтому электронная плотность на атоме водорода в группе ОН оказывается пониженной, а на атоме кислорода - повышенной. Тем не менее, в водных растворах ионизация этой связи не происходит, следовательно, спирты являются неэлектролитами. Физические свойстваПервые десять членов гомологического ряда алканолов являются жидкостями, высшие спирты - твердые вещества. Таким образом, спирты обладают аномально высокими температурами кипения по сравнению с алканами. Это объясняется ассоциацией молекул спиртов вследствие образования межмолекулярных водородных связей: Все алканолы легче воды, бесцветны. Метанол, этанол и пропанол неограниченно растворяются в воде; с увеличением числа атомов углерода растворимость спиртов уменьшается. Химические свойства алканолов2C2H5O-H + 2Na → 22H6ONa + h3↑ этанол → этилат натрия (этоксид натрия) Алкоголяты подвергаются практически необратимому гидролизу: 2C2H5ONa + h3O → 22H5OH + HOH Необратимость этой реакции доказывает, что спирты не проявляют кислотных свойств (точнее, что кислотные свойства спиртов выражены слабее, чем у воды). Спирты можно превратить в галогеналканы также действием галогенидов фосфора и тионилхлорида: 4. Замещение гидроксильной группы на аминогруппу (образуются амины) 1. Межмолекулярная дегидратация (образуются простые эфиры) (Правило Зайцева!) 3. Дегидрирование (образуются альдегиды в случае первичных спиртов и кетоны - в случае вторичных спиртов) Третичные спирты не дегидрируются. 1. Горение (Реакция идет с выделением большого количества теплоты; на этом основано применение лабораторных спиртовок.) 2. Неполное окисление под действием различных окислителем (образуются альдегиды в случае первичных спиртов и кетоны в случае вторичных спиртов) При неполном окислении спиртов образуются те же продукты, что и при их дегидрировании. Таким образом, реакции дегидрирования по своей сути являются реакциями окисления. Образующиеся при окислении первичных спиртов альдегиды далее легко окисляются до карбоновых кислот, поэтому можно записывать суммарные уравнения, например: 5С2Н5ОН + 4КМnO4 + 6h3SO4 → 5СН3СООН + 2K2SO4 + 4MnSO4 + 11Н2O этанол → уксусная кислота 1. Гидратация алкенов См. «Алкены» 2. Щелочной гидролиз галогеналканов СН3СН2СН2Вг + КОН → СН3СН2СН2ОН + КВr 1-бромпропан → пропанол-1 (Обратите внимание на отличие этой реакции от взаимодействия галогеналканов со спиртовыми р-рами щелочей, в результате которого образуются алкены.) 3. Гидрирование альдегидов и кетонов Гидрирование альдегидов и кетонов является их восстановлением. 4. Гидролиз сложных эфиров (кислотный и щелочной) 1. Синтез из водяного газа 2. Спиртовое брожение глюкозы examchemistry.com СН3СН2ОН.... а ЭТО точно ОН?Разве что тебе пропанол нужон, то - да. А что показала дегустация? сейчас все оно, а это ОН Судя по вашей фотке, вы что-то перепутали... не, я пью С2Н5ОН ))))))))))) ...точно... самогон!... Удачи! Жив будешь - поделись впечатлениями ! С2Н5ОН - лучше пьется)) Зачем вам этанол? Приходите, у меня сейчас самогоночка свежая капать начала))) touch.otvet.mail.ru Х и м и яОрганическая химияСпирты.Спирты – это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильными группами (ОН). Так метиловый спирт СН3-ОН представляет собой гидроксильное производное метана СН4, этиловый спирт С2Н5-ОН – производное этана.
Название спиртов образуется добавлением окончания «-ол» к названию соответствующего углеводорода (метанол, этанол и т.д)
Производные ароматических углеводородов с группой ОН в бензольном ядре называются фенолами.
Свойства спиртов.Подобно молекулам воды, молекулы низших спиртов связываются между собой водородными связями. По этой причине температура кипения спиртов выше, чем температура кипения соответствующих углеводородов. Общим свойством спиртов и фенолов является подвижность водорода гидроксильной группы. При действии на спирт щелочного метала этот водород вытесняется металом и получаются твёрдые, растворимые в спирте соединения, называемые алкоголятами. Спирты взаимодействуют с кислотами, образуя сложные эфиры. Спирты значительно легче окисляются, чем соответствующие углеводороды. При этом образуются альдегиды и кетоны. Спирты практически не являются электролитами, т.е. не прводят электрический ток. Метиловый спирт.Метиловый спирт (метанол) СН3ОН – бесцветная жидкость. Весьма ядовит: приём небольших его доз вутрь вызывает слепоту, а больших – смерть. Метиловый спирт получают в больших количествах синтезом из окиси углерода и водорода при высоком давлении (200-300 атм.) и высокой температуре (400 град С) в присутствии катализатора.
Метиловый спирт образуется при сухой перегонке дерева; поэтому его также называют древесным спиртом. Он применяется как растворитель, а также для получения других органических веществ. Этиловый спирт.Этиловый спирт (этанол) С2Н5ОН – одно из важнейших исходных веществ в современной промышленности органического синтеза. Для получения его издавна пользуются различными сахаристыми веществами, которые путём брожения превращаются в этиловый спирт. Брожение вызывается действием ферментов (энзимов), вырабатываемых дрожжевыми грибками. В качестве сахаристых веществ используют виноградный сахар или глюкозу :
Глюкоза в свободном виде содержится, например, в виноградном соке, при брожении которого получается виноградное вино с содержанием спирта от 8 до 16%. Исходным продуктом для получения спирта может служить полисахарид крахмалл, cодержащийся, например в клубнях картофеля, зерна ржи, пшеницы, кукурузы. Для превращения в сахаристые вещества (глюкозу) крахмал предварительно подвергают гидролизу. В настоящее время осахариванию подвергается также другой полисахарид – целюлозу (клетчатку), образующую главную массу древесины. Целюлозу (например, древесные опилки) также предварительно подвергают гидролизу в присутствии кислот. Полученный таким образом продукт также содержит глюкозу и сбраживается на спирт при помощи дрожжей. Наконец, этиловый спирт может быть получен синтетическим путём из этилена. Суммарная реакция заключается в присоединении воды к этилену.
Реакция протекает в присутствии катализаторов. Многоатомные спирты.До сих пор мы рассматривали спирты с одной гидроксильной группой (ОН). Такие спирты называются алкоголями. Но также известны спирты, молекулы которых содержат несколько гидроксильных групп. Такие спирты называются многоатомными. Примерами таких спиртов могут служить двухатомный спирт этиленгликоль и трёхатомный спирт глицерин:
Этиленгликоль и глицерин – жидкости сладковатого вкуса, смешивающиеся с водой в любых соотношениях. Использование многоатомных спиртов.Этиленгликоль применяется в качестве составной части, так называемых антифризов, т.е. веществ с низкой температурой замерзания, заменяющих воду в радиаторах автомобильных и авиационных моторов в зимнее время. Также, этиленгликоль используют в производстве целлофана, полиуретанов и ряда других полимеров, как растворитель красящих веществ, в органическом синтезе. Область применения глицерина разнообразна: пищевая промышленность, табачное производство, медицинская промышленность, производство моющих и косметических средств, сельское хозяйство, текстильная, бумажная и кожевенная отрасли промышленности, производство пластмасс, лакокрасочная промышленность, электротехника и радиотехника. Глицерин относится к группе стабилизаторов. При этом, он обладает свойствами сохранять и увеличивать степень вязкости различных продуктов, и таким образом менять их консистенцию. Зарегистрирован как пищевая добавка Е422, и используется в качестве эмульгатора, при помощи которого смешиваются различные несмешиваемые смеси. xn----7sbb4aandjwsmn3a8g6b.xn--p1ai |
Цельнозерновые злаковые
Цельнозерновые злаковые – это «медленные» углеводы. Тут и хлеб, и макаронные изделия, хотя бы на 50% состоящие из цельнозерновой муки, и нешлифованный коричневый рис.
Жиры
Только полезные жиры! Оливковое, рапсовое, подсолнечное и другие растительные масла подойдут для салата.
Фрукты
Употребляйте достаточно фруктов – всех цветов и размеров. Они обеспечивают вас витаминами и микроэлементами и отлично заменят десерт. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||