НОВОСТИ |
Сера и её характеристики. Сера как выглядитСера и её характеристикиОбщая характеристика серыСера встречается в природе как в свободном состоянии (самородная сера), так и в различных соединениях. Очень распространены соединения серы с различными металлами. Многие из них являются ценными рудами (например, свинцовый блеск PbS, цинковая обманка ZnS, медный блеск Cu2S) и служат источником получения цветных металлов. Из соединений серы в природе также распространены сульфаты, главным образом, кальция и магния, Наконец, соединения серы содержатся в организмах растений и животных. Общее содержание серы земной коре составляет приблизительно 0,1%. Атомная и молекулярная масса серыОтносительной молекулярная масса вещества (Mr) – это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента (Ar) – во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода. Значения атомной и молекулярной масс серы совпадают; они равны 32,059. Аллотропия и аллотропные модификации серыСера существует в виде двух аллотропных модификаций – ромбической и моноклинной. При обычных давлениях сера образует хрупкие кристаллы желтого цвета, плавящиеся при 112,8oС; плотность равна 2,07 г/см 3. Она нерастворима в воде, но довольно хорошо растворима в сероуглероде, бензоле и некоторых других жидкостях. При испарении этих жидкостей сера выделяется из раствора в виде желтых кристаллов ромбической системы, имеющих форму октаэдров, у которых обычно часть углов или ребер как бы срезана (рис.1). Эта модификация серы называется ромбической. 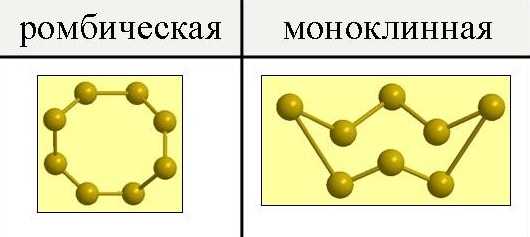 Рис. 1. Аллотропные модификации серы. Иной формы кристаллы получаются, если медленно охлаждать расплавленную серу и, когда она частично затвердевает, слить еще не успевшую застыть жидкость. При этих условиях стенки сосуда оказываются покрыты изнутри длинными темно-желтыми игольчатыми кристаллами моноклинной системы. Эта модификация серы называется моноклинной. Она имеет плотность 1,96 г/см 3, плавится при 119,3oС и устойчива только при температуре выше 96oС. Изотопы серыИзвестно, что в природе сера может находиться в виде четырех стабильных изотопов 32S, 33S, 34S и 36S. Их массовые числа равны 32, 33, 34 и 36 соответственно. Ядро атома изотопа серы 32S содержит шестнадцать протонов и шестнадцать нейтронов, а изотопов 33S, 34S и 36S– такое же количество протонов, семнадцать, восемнадцать и двадцать нейтронов соответственно. Существуют искусственные изотопы серы с массовыми числами от 26-ти до 49-ти, среди которых наиболее стабильным является 35S с периодом полураспада равным 87 суток. Ионы серыНа внешнем энергетическом уровне атома серы имеется шесть электронов, которые являются валентными: 1s22s22p63s23p4. В результате химического взаимодействия сера может терять свои валентные электроны, т.е. являться их донором, и превращаться в положительно заряженные ионы или принимать электроны другого атома, т.е. являться их акцептором, и превращаться в отрицательно заряженные ионы: S0 –6e → S6+; S0 -4e → S4+; S0 -4e → S2+; So +2e → S2-. Молекула и атом серыМолекула серы одноатомна — S. Приведем некоторые свойства, характеризующие атом и молекулу серы:
Примеры решения задачru.solverbook.com существует ли? Физические и химические свойства серыСера является 10-м по распространенности элементом во Вселенной. Она не имеет запаха, это безвкусное, пластичное твердое вещество ярко-желтого цвета. Это реактивный элемент, который при благоприятных условиях сочетается со всеми другими элементами, кроме газов, золота и платины. Металлический блеск серы присутствует в некоторых сернистых соединениях, но не в чистом виде. Сера появляется в различных аллотропных модификациях, каждая из которых отличается по растворимости, удельному весу, кристаллической аранжировке и другим физическим константам. При воздействии чистого кислорода происходит горение синего цвета, образующий оксид серы. |
||||||||||||||||||||||||||||
Потребность с/х культур в сере и симптомы её недостатка, согласно данным:[6][5] | ||
Культура | П | Симптомы недостатка |
Бобовые | В | Вся листовая пластинка молодых листьев, в том числе жилки, светло-зеленой или желтой окраски; На поздних стадиях старые листья желтеют; Содержание белков низкое |
Горчица | В | Замедление развития растений; Уменьшение размера листьев, стебли удлиняются, листья и черешки деревянистые; В отличие от азотного голодания, при серном листья не отмирают, хотя цвет их становиться бледным |
Капуста и другие крестоцветные | В | Замедляется развитие растений; Уменьшается размер листьев, стебли удлиняются, листья и черешки деревянистые; В отличие от азотного голодания, при серном листья не отмирают, хотя цвет их становиться бледным |
Томаты | В | Нижние листья желтовато-зеленые; Стебли твердые, деревянистые; Корневая система хорошо развита в длину и сильно ветвится, но диаметр корней и стеблей мал; Стебли томатов удлиняются без увеличения диаметра; В растении много углеводов и иногда азота |
Огурцы | В | Рост растений ограничен; Листья маленькие, загнуты вниз, бледно-зеленые до желтого, на старых листьях желтизны меньше; Края молодых листьев зазубрены |
Круговорот серы в почве
Растения перехватывают минеральную серу и возвращают в верхние слои почвы снова в виде органических веществ. Таким образом, совершается непрерывное преобразование форм серы в процессах обмена веществ между растениями и почвой.[2]
Содержание сульфатов в почве меняется в течение сезона. Больше всего сульфатов в почве в летнее время. Именно тогда, когда минерализация (сульфофикация) идет наиболее активно.[1]
отличаются большим содержанием серы. часто бедны по содержанию соединений серы.[5]характеризуются наличием доступной для растений сульфатной серы в количестве от 30 до 90 кг/га. Дефицит серы в данном типе почв ощутим на легких малогумусных и переувлажненных почвах.[1]Роль в растении
Биохимические функции
Сера активно участвует в окислительно-восстановительных процессах, активировании энзимов, белковом обмене. Она способствует фиксации азота из атмосферы путем усиления образования клубеньков у бобовых.[5]
Сера является составной частью белков и содержится в важнейших аминокислотах – цистине и метионине. Встречается данный элемент и в других органических соединениях – в аллил-горчичном масле из горчичных семян, в чесночном масле. Сера входит также в состав гликозидов, витамина В, биотина, некоторых антибиотиков (пенициллина).[2]
Важнейшее соединение, содержащее серу и участвующее в окислительно-восстановительных реакциях – глутатион. В его состав сера входит в виде производного цистина – цистеина. Цистин содержит серу в виде дисульфидной группы, цистеин – в виде сульфгидрильной.[2]
В растущих органах растений с преобладанием синтетических процессов сера обнаруживается в восстановленной форме. По мере старения, когда процессы гидролиза начинают преобладать над процессами синтеза, в растении возрастает количество окисленной формы соединений серы.[5]
Сера поглощается растениями из почвы только в виде аниона серной кислоты (в окисленной форме). Однако во всех выше указанных соединениях она содержится в восстановленной форме (восстановителями сульфатов в растениях выступают углеводы). И именно в таком виде элемент участвует в окислительно-восстановительных процессах, связанных с дыханием.[2]
С органическими веществами сера связана дисульфидной (-S-S-) или сульфгидрильной (-SH) группами. Эти группы выполняют важные функции в процессе окислительно-восстановительных реакций. В частности, сульфгидрильная группа при окислении теряет водород и превращается в дисульфидную группу.[5]
Источником питания серой для растений служат соли серной кислоты. Частично сера в виде сернистого газа (SO2) поглощается растениями из воздуха. Окисленная форма серы – исходный продукт для синтеза белков. Эта же форма является и конечным продуктом при распаде белковой молекулы.[5]
 Дефицит серы
Дефицит серы Дефицит серы

1 - у табака, 2 – у пшеницы (справа)
Использованы изображения:[9][8]
Недостаток (дефицит) серы в растениях
Недостаток серы приводит к задержке синтеза белков, поскольку затрудняется образование аминокислот, содержащих данный элемент. Из-за этого визуальные проявления недостаточности серы похожи на признаки азотного голодания: замедляется развитие растений, уменьшается размер листьев, стебли удлиняются, листья и черешки становятся деревянистыми. В отличие от азотного голодания, при серном листья не отмирают, хотя их цвет становится бледным.
Установлено, что бобовые и крестоцветные не испытывают недостатка в сере, если в почве содержится сульфатов более 11–14 мг/кг, злаковые – если более 7 мг/кг.[5]
Избыток серы
Избыток серы в почве незначительно снижает урожайность растений из семейства крестоцветных. Так же он влияет и на злаковые. Урожайность злаковых снижается значительнее, чем крестоцветных. Визуально наблюдается общее огрубение растений, листья мельчают, края их становятся коричневыми, затем бледно-желтыми.[6]
Симптомы избытка:
:- Снижается урожай,
- Общее огрубение растений,
- Листья маленькие, тускло-зеленые, стебли твердые, поздние листья скручиваются внутрь и покрываются наростами,
- Края коричневые, позднее – бледно–желтые.
Содержание серы в различных соединениях
Чистая сера – слишком дорогой продукт для использования в качестве удобрения в больших количествах. Но в районах расположения месторождений серы с недостаточным процентом элемента для использования в промышленности серные породы служат удобрением.[2]
В основном для устранения серной недостаточности используются серосодержащие удобрения:
- Простой суперфосфат (20 % P2O5, 13 % S). С ним на поля поступает преобладающее количество серы. В связи с тем, что потребность в фосфоре и сере приблизительно одинакова, при внесении данного удобрения удовлетворяется и потребность в сере.
- Сульфат аммония (21 % N, 24 % S) – второе место по снабжению почвы серой.
- Сернокислый калий (48 % K2O, 17,6 % S) и калимагнезия (28 % K2O, 18,3 % S) – калийные, бесхлорные удобрения. Применяются в ограниченном количестве и поэтому играют небольшую роль в обеспечении почв серой.
- Гипс (18,6 % S) хорошо доступен растениям. Представляет собой быстродействующую нейтральную сернокислую соль кальция.
- Фосфогипс (22 % S) – отходы химических заводов, выпускающих двойной суперфосфат. Подобен гипсу по составу, но включает в себя примеси фосфора и других элементов. Служит серосодержащим удобрением местного значения. Его недостаток – влажность 30–35 %.
- Сульфат магния содержит 28–30 % серы. Данное удобрение используется в закрытом грунте.[4]
- Полисульфид аммония – темная, красно-бурая, до черного цвета жидкость. Содержит около 20 % азота и 40 % серы.
- Тиосульфат аммония – жидкость красноватого цвета, содержит 12 % азота и 26 % серы.[2]
- Навоз – содержит серу в количестве до 1 кг SO3 в 1 т или от 0,6 до 0,15 %.[5]
Кроме указанных удобрений, сера входит в состав сульфатной нитрофоски и некоторых микроэлементов, а также поступает в почву с навозом и пестицидами.[4]
www.pesticidy.ru
Свойства и применение серы — Знаешь как
Рис. 87. Получение пластической серы
Сера принадлежит к числу элементов, которые в свободном состоянии образуют несколько аллотропических видоизменений.
Чистая природная сера — твердое, кристаллическое вещество желтого цвета с уд. весом 2,07, плавящееся при 112,8°. Она нерастворима в воде, но довольно хорошо растворяется в сероуглероде, бензоле и некоторых других жидкостях. При испарении этих жидкостей сера выделяется из раствора в виде прозрачных желтых кристаллов ромбической, системы, имеющих, форму октаэдров, у которых обычно часть углов или ребер как бы срезана (рис. 85). Такая сера называется ромбической. Продажная черенковая сера состоит из таких же кристаллов, но только очень мелких и плохо образованных.
Совершенно иной формы кристаллы получаются, если медленно охлаждать расплавленную серу в каком-нибудь сосуде и, когда она частично затвердеет, слить еще не успевшую застыть часть серы. При этих условиях стенки сосуда оказываются покрытыми изнутри множеством длинных темножелтых игольчатых кристаллов моноклинической системы (рис, 86). Эта моноклиническая сера имеет уд. вес 1,96 и плавится при 119°. Однако она может оставаться без изменения только при температуре выше 96°. При обыкновенной температуре кристаллы моноклинической серы скоро светлеют и приобретают все свойства ромбической серы. Хотя внешне эти кристаллы сохраняют еще призматическую форму, но они уже состоят из мельчайших кристалликов-октаэдров, на которые и распадаются при сотрясении.
Температура их плавления и удельный вес становятся такими же, как и у ромбической серы.
Рис. 85. Кристаллы ромбической серы
Очень интересны изменения, которые претерпевает сера, если медленно нагревать ее до точки кипения. При 112,8° она плавится, превращаясь в желтую легкоподвижную жидкость. При дальнейшем нагревании жидкость темнеет, приобретая красновато-бурый цвет, и при температуре около 250° становится настолько густой, что некоторое время не выливается из опрокинутого сосуда. Выше 300° жидкая сера снова становится подвижной, но цвет ее остается таким же темным. Наконец, при 444,6° сера закипает, образуя оранжево-желтые пары. При охлаждении те же явления повторяются в обратном порядке.
Если расплавленную серу, нагретую до кипения, вылить тонкой струей в холодную воду, то она превращается в мягкую резиноподобную коричневую массу, растягивающуюся в нити (рис. 87). Эта модификация серы называется пластической серой. Пластическая сера уже через несколько часов становится хрупкой, приобретает желтый цвет и постепенно превращается в ромбическую серу.
Кроме трех рассмотренных видоизменений серы, известны также и другие, на которых мы не будем останавливаться. Все они неустойчивы и довольно быстро превращаются в ромбическую серу. Поэтому в природе сера встречается только в ромбической форме.
Результаты определения молекулярного веса серы по понижению точки замерзания ее растворов в бензоле приводят к заключению, что молекулы серы при этих условиях состоят из восьми атомов (S8). Из таких же молекул построены, невидимому, и кристаллы серы. Таким образом, различие в свойствах кристаллических модификаций серы обусловливается не различным числом атомов в молекулах (как, например, в молекулах кислорода и озона), а неодинаковой структурой кристаллов (полиморфизм) .
Рис. 86. Кристалл моноклинической серы
Пары серы при низких температурах состоят главным образом из молекул S6, а выше 800° — из молекул S2.
Сера является типичным металлоидом. Со многими металлами, например с медью, железом, цинком и др., она соединяется непосредственно с выделением значительного количества тепла. Сера соединяется также почти со всеми металлоидами, но далеко не так легко и энергично, как с металлами.С кислородом сера дает несколько окислов, из которых два самые важные —SO2и SO3— являются ангидридами кислот сернистой h3SO3и серной h3SO4.Соединение серы с водородом — газ сероводород h3S — в водном растворе также обладает кислотными свойствами.
Сера широко используется в народном хозяйстве. В виде серного цвета она применяется в больших количествах для уничтожения некоторых вредителей садовых культур.
В резиновой промышленности сера применяется для превращения каучука в резину; свои ценные свойства — упругость, эластичность и др. — каучук приобретает только после смешивания с серой и нагревания до определенной температуры. Такой процесс называется вулканизацией.
Каучук с очень большим содержанием серы называют эбонитом. Он представляет собой твердое вещество, являющееся очень хорошим электрическим изолятором. Затем сера применяется для приготовления черного пороха, спичек, бенгальских огней, ультрамарина (синяя краска), сероуглерода и целого ряда других веществ. В странах, богатых серой, она является также исходным сырьем для получения серной кислоты. В медицине сера применяется для лечения некоторых кожных болезней.
119 120 121
Вы читаете, статья на тему Свойства и применение серы
znaesh-kak.com
Сера | Химия свойства элементов
Общие сведения и методы получения
Сера (S) — неметалл, представляющий собой хрупкие кристаллы желтого цвета.
Известна с древнейших времен (за 2000 лет до н.э.). Элементарную природу серы установил французский химик Лавуазье. В 1822 г, Ми-черлих обнаружил аллотропию серы. Название элемента связано с его цветом — от латинского «sulfur» светло-желтый. Русское название «сера» происходит от санскритского «сира», что также означает светло-желтый; имеется и другое древнерусское название серы «жупель» — сера горючая.
Общее содержание серы в земной коре составляет —0,1 % (по массе).
Сера встречается в природе как в свободном виде (самородная), так и в соединениях.
Известно более 200 минералов, содержащих серу. Наиболее распространены соединения серы с различными металлами — сульфиды: PbS — свинцовый блеск; ZnS — цинковая обманка; Cu2S —медный блеск; FeS2 — пирит; HgS — киноварь и др. Широко распространены в природе также сульфаты: Na2SO|- 10Н2О — глауберов»! соль; BaS04— тяжелый шпат; CaS04-2h30 — гипс и др. В виде сульфатов натрия, калия, магния и других элементов сера содержится в водах мирового океана (0,08—0,09 %), в углях, нефти, сланцах, природных газах.
Элементарную серу получают из самородных руд, используя ее способность легко плавиться. Полученную серу очищают перегонкой в рафинировочных печах, где она нагревается до кипения и конденсируется на стенках камеры в виде светло-желтого порошка или при температуре свыше 120 °С в виде жидкости, которую выпускают из камеры в формы, где она застывает в виде лалочек.
Серу получают также из сероводорода h3S и восстановлением диоксида серы S02.
Важными источниками получения серы являются пирит FeS2 и полиметаллические руды, содержащие сернистые соединения меди, цинка и других цветных металлов. Некоторое количество серы (газовая сера) получают из газов, образующихся при коксовании и газификации угля.
Физические свойства
Атомные характеристики. Атомный номер 16, атомная масса 32,064 а. е. м., атомный объем 15,38*10-6 м3/моль, атомный радиус 0,104 нм, ионные радиусы s2- 0,174 нм, s+ 0,037 нм, s6+ 0,034 нм. Конфигурация внешних электронных оболочек 3s23p4. Значения потенциалов ионизации / (эВ): 10,357; 23,4; 34,8. Сродство к электрону 2,07—2,33 эВ. Электроотрицательность 2,6.
Существует ряд кристаллических и аморфных модификаций серы. До 95,6 °С устойчива ромбическая, или a-S, с параметрами а= 1,04646 нм, 6=1,28660 нм, с = 2,44860 нм; в интервале 95,6—119,3°С моноклинная, или B -S, с параметрами решетки а=0,090 нм, 6=1,096 нм, с= 1,102 нм; 6 = 86 16'. Энергия кристаллической решетки серы 223,0 мкДж/ /кмоль. Выше 119,3°С Й -S переходит в жидкую X-S. При быстром нагреве ромбическая a-S непосредственно превращается в подвижную жидкость соломенного цвета X-S.
В жидкой сере наблюдается равновесие A ,-S =<=tB -s +n -s и при 160 °С в ней содержится 89,2 % ^-S; 4,1 % p-S; 6,7 % я -S.
Аморфная темно-красная пластическая p-S образуется при резком охлаждении жидкой серы; она нерастворима в сероуглероде и быстро переходит в ромбическую a-S.
Химические свойства
В соединениях сера проявляет степени окисления —2, +2, +3, +4, +5, +6.
Элементарная сера химически активна и взаимодействует при нагревании со многими металлами и неметаллами (за исключением золота, платины, азота, иода и инертных газов), с органическими и неорганическими соединениями. При комнатной температуре во влажном воздухе сера слабо окисляется, при 280 °С она горит в кислороде, а при 360 °С — на воздухе. Смесь паров серы и кислорода взрывается.
При обычных условиях сера с кислородом не взаимодействует. При цагреваиии на воздухе или в кислороде сера образует оксиды: S02 — оксид серы (IV), или сернистый газ, представляющий собой бесцветный газ с резким удушливым запахом, легко конденсирующийся в бесцветную жидкость, кипящую при —10 °С, хорошо растворяющуюся в воде с образованием сернистой кислоты h3S03; S03 — оксид серы (VI), серный ангидрид, представляющий собой бесцветную легкоподвижную жидкость, кипящую при 44,7 "С и кристаллизующуюся при 16,9 °С; при хранении в присутствии следов влаги превращается в длинные шелковистые кристаллы, хорошо растворяется в воде, образуя серную кислоту h3S04. Известны малоустойчивые оксиды серы: S20, SO, S203, S04, S07, S3O10.
Существует ряд кислородсодержащих кислот: h3S03— сернистая кислота — непрочное соединение, существует только в водных растворах, окисляется кислородом воздуха, превращаясь в серную кислоту h3S04, хороший восстановитель, двухосновная кислота, образует два ряда солей: сульфиты и гидросульфиты!
h3S04 — серная кислота — бесцветная маслянистая жидкость без запаха, нелетучая, кристаллизующаяся при 10,3 °С, тяжелая, активно поглощает пары воды, сильный окислитель, двухосновная кислота, образует два ряда солей: сульфаты и гидросульфаты, из которых практически нерастворимы только BaS04, PbS04 и SrS04.
h3S207 — пиросерная, или двусерная кислота. Растворением серного ангидрида S03 в серной кислоте получают олеум, состоящий главным образом из пиросерной кислоты. При охлаждении олеума кислота выделяется в виде бесцветных кристаллов. Пиросерная кислота образует соли — дисульфаты или пиросульфаты, которые при нагревании выше температуры плавления разлагаются, превращаясь в сульфаты.
h3S02 — сульфоксиловая кислота; в свободном состоянии не выделена.
h3S208 —пероксодвусерная, или надсерная, кислота, обладает сильными окислительными свойствами, образует соли персульфаты.
h3S202 — тиосернистая кислота, образуется как промежуточный продукт при различных реакциях.
h3S203 — тиосерная кислота — неустойчива, уже при комнатной температуре распадается, образует соли — тиосульфаты, которые значительно устойчивее кислоты.
h3S204 — дитионистая кислота, существует только в виде солей.
Существует группа политионовых кислот, отвечающих общей форму, ле h3S*06, где х принимает значения от 2 до 6. К группе таких кислот принадлежат h3S4O0 (тетратионовая кислота) и h3S2Oe (дитионовая кислота). Политионовые кислоты неустойчивы и известны лишь в водных растворах. Соли их — полнтионаты — более устойчивы, некоторые из них получены в виде кристаллов.
При обычных условиях сера с водородом ие соединяется, при нагревании образует соединения, отвечающие общей формуле PbS* — суль-фаны; h3S — сероводород; h3S2 — двухсернистый водород; h3S3 — трех-сернистый водород и т. д. Водные растворы сульфанов обладают свойствами слабых двухосновных кислот. Сероводород h3S —бесцветный газ с характерным запахом, ядовитый, немного тяжелее воздуха, горючий, легко воспламеняется, сильный восстановитель, хорошо растворяется в воде, образуя сероводородную кислоту, соли которой — сульфиды.
Остальные сульфаны — малоустойчивые желтоватые маслянистые жидкости; растворимы в воде с образованием соответствующих кислот, соли которых — полисульфиды.
Сера взаимодействует почти со всеми металлами (кроме золота, иридия, платины), образуя сульфиды. Прн комнатной температуре сера соединяется со щелочными н щелочноземельными металлами, а также с Си, Ag, Hg; при иагреваиин — с Pb, Sn, Ni, Со, Zn, Mn, Cr, Al; в присут ствии влаги — с Fe; тугоплавкие металлы н некоторые металлы платиновой группы взаимодействуют с серой прн высокой температуре в мелкораздробленном состоянии; некоторые — с парами серы под дав лением.
Различают основные сульфиды (Na2S, MgS), амфотерные (A1 2 S3, Cr 2 S3) и кислотные (MoS, WS3). Сульфиды могут соединяться друг с другом, образуя тиосоли (например. Na2WS4 — тиовольфрамат натрия).
Соединения серы с азотом получены косвенным путем. Известны N4S4 —азотистая сера — золотисто-желтые кристаллы с температурой плавления 178 °С; при ударе и нагревании выше температуры плавления разлагаются на элементы, в воде не растворяются; N2 S4 — четырехсер-иистый азот — темно-красные кристаллы с температурой плавления 23 °С, постепенно самопроизвольно разлагающиеся; при нагревании вспыхивают, в воде не растворяются; N2Ss — сернистый азот.
При 800—900 °С сера взаимодействует с углеродом, образуя сероуглерод CS2 — бесцветную жидкость, которая кипит при 40 °С, плохо растворяется в воде; сероуглерод хорошо растворяет жиры, масла, смолы, склонен к полимеризации. При взаимодействии углерода, кислорода и серы при высокой температуре образуется серооксид COS. Известны неустойчивые низшие сульфиды углерода: CS — белый налет, который уже при —180 "С со взрывом превращается в коричневый продукт полимери. зации (OS)*; несколько более устойчива C3S2 —слезоточивая жидкость, затвердевающая при 5 °С и склонная к полимеризации.
При сплавлении фосфора с серой, взятых в соответствующих соотношениях, образуются тиоангидриды P4S3, P4S5, P4S7, P4Si0, которые гид-ролизуются во влажном воздухе с выделением фосфииа РН3.
Галогены, за исключением иода, непосредственно соединяются с се рой. Уже на холоду сера энергично взаимодействует со фтором, образуя ряд соединений: SF6 — бесцветный газ, термически и химически стойкий, не реагирующий с водой, соляной кислотой, едким натром, водородом и кислородом; SF4 — бесцветный газ, энергично взаимодействующий с во-дой, термически устойчивый до 600 °С, хороший фторирующий агент; S2Fi0 и др.
При полном отсутствии влаги уже при комнатной температуре сера взаимодействует с хлором н бромом, образуя соединения: S2C19 — оранжево-желтую маслянистую жидкость с температурой кипения 137 "С, хорошо растворяющую серу, дымящую во влажном воздухе; в воде подвергается гидролизу; SC12 — красную жидкость с удушливым за. пахом, гидролитически разлагающуюся водой; SC14 — белый порошок, устойчивый только в твердом состоянии при низкой температуре; S2Br2 — красную маслянистую жидкость, очень чувствительную к влаге воздуха; прн температуре выше 90 °С разлагается на элементы.
Соединения серы с иодом неустойчивы, легко разлагаются. Получены соединения S*I2, где х —от 2 до 6.
Кроме того, известны галогенопроизводные сульфанов, имеющие общую формулу Sx(^)2, где X — галогены. Многообразны оксигалогениды серы общей формулы SO(A")2и S02(X)2.
С водой и разбавленными кислотами сера не взаимодействует. Концентрированная азотная кислота окисляет серу до серной кислоты. Соляная кислота не действует на серу, но в присутствии окислителей пе реводит серу в серную кислоту. Царская водка также окисляет серу до серной кислоты. Концентрированная серная кислота на холоду на серу не действует, с расплавленной серой реагирует с образованием сернисто го газа S02и воды.
Со щелочами сера взаимодействует с образованием сульфидов и сульфитов (реакция обратимая). При нагревании в растворе аммиака Nh4 сера образует полисульфид и тиосульфат аммония.
Расплавленная сера реагирует с оксидами щелочных металлов с образованием сульфидов, сульфитов и сульфатов. С оксидами тяжелых металлов сера заметно взаимодействует при 150—200 °С с выделением сернистого газа.
В воде сера практически не растворяется, хорошо растворяется в безводном аммиаке, сероуглероде и ряде органических растворителей (феноле, бензоле, дихлорэтане и др.).
Области применения
Основной потребитель серы — химическая промышленность: около 50% добываемой серы идет на производство серной кислоты. Большое количество серы расходуется в резиновой и целлюлозно-бумажной промышленности, вискозном и спичечном производстве, в органическом синтезе (получение сернистых красителей, сероуглерода, искусственных волокон, фармацевтических препаратов, ускорителей вулканизации каучука). Серу применяют при получении различных цементов, замазок, асфальтов, дымного пороха, светящихся составов, бенгальских огней.
В сельском хозяйстве серу широко применяют в виде серного цвета, используя для уничтожения некоторых вредителей растений; серные удобрения повышают морозостойкость растений и злаков.
Добавки серы улучшают обрабатываемость автоматных сталей и антифрикционные свойства спеченных антифрикционных материалов.
В медицине используют как элементарную серу, так и ее соединения. Все сульфамидные препараты — это органические соединения серы.
Широко применяются соединения серы:
— FeS2 (пирит) — для получения серной кислоты; сульфиды щелочных и щелочноземельных металлов (Na2S, CaS и BaS) —в кожевенной промышленности; сульфиды цинка ZnS и кадмия CdS служат основой люминофоров; некоторые сульфиды обладают полупроводниковыми свойствами и применяются в электронной технике; многие природные сульфиды используются в металлургии для выплавки цветных и редких металлов;
— оксид серы (IV) S02 — для получения серной кислоты; для отбеливания соломы, шерсти, шелка; как дезинфицирующее средство; для лечения домашних животных;
— сульфиты калия K2S03 и натрия Na2S0.3 для отбеливания некоторых материалов в текстильной промышленности при крашении тканей, в фотографии;
— гидросульфит кальция Ca(HS03)2 — при переработке древесины в сульфитную целлюлозу, из которой затем получают бумагу;
— сульфат натрия Na2S04 — при производстве стекла; глауберову соль Na2SO4-10h3O в медицине; гипс CaS04-2h30 для изготовления отливочных форм и слепков с различных предметов, в строительстве, в хирургии; медный купорос CaS04-5h30 — в сельском хозяйстве, для приготовления минеральных красок, для электролитического покрытия металлов медью; алюмокалиевые квасцы KA1(S04)2- 12Н20 — для дубления кожи, в красильном деле;
— олеум h3S207 — для очистки нефтепродуктов, для производства некоторых красителей и взрывчатых веществ;
— серная кислота h3S04 — для получения минеральных удобрений, некоторых кислот (НС1, Н3Р04 и др.), взрывчатых веществ, красок, при очистке керосина, нефтяных масел и продуктов коксохимического производства (бензола, толуола), при травлении черных металлов (снятия окалины), в свинцовых аккумуляторах;
— персульфаты — как средства для отбелки, в качестве окислителей в лабораторной практике и для некоторых технических целей;
— тиосульфат натрия Na2S203 — в фотографии как закрепитель, в текстильной промышленности для удаления остатков хлора после отбелки тканей, в медицине и ветеринарии;
— хлорид серы (I) S2C12 — для вулканизации каучука.
ibrain.kz
Цельнозерновые злаковые – это «медленные» углеводы. Тут и хлеб, и макаронные изделия, хотя бы на 50% состоящие из цельнозерновой муки, и нешлифованный коричневый рис.
Только полезные жиры! Оливковое, рапсовое, подсолнечное и другие растительные масла подойдут для салата.
Употребляйте достаточно фруктов – всех цветов и размеров. Они обеспечивают вас витаминами и микроэлементами и отлично заменят десерт.

























